深圳市默赛尔生物医学科技发展有限公司
6 年
手机商铺
商家活跃:
产品热度:
- NaN
- 0.7000000000000002
- 0.7000000000000002
- 1.7000000000000002
- 0.7000000000000002
推荐产品
公司新闻/正文
CAR-NK 细胞疗法:利用先天免疫的力量
2858 人阅读发布时间:2021-11-10 17:09
(由于篇幅受限以下内容为节选,全文请至文末出处查阅)
摘要
免疫治疗 NK 细胞的来源
利用基因工程改造 NK 细胞
增强 NK 细胞的增殖和持久性
针对免疫检查点
以免疫检查点为基础的疗法,已经在一些癌症患者中取得了重大的临床进展和长期缓解和可能的治愈的前景。许多研究证据表明靶向 NK 细胞中的检查点对肿瘤治疗具有重要作用。NKG2A 是一种抑制受体,采用抗 NKG2A 单克隆抗体与西妥昔单抗联合在一项 II 期试验中用于 26 例头颈部难治性鳞状细胞癌患者,其中 8 名患者获得部分缓解 (31%),14 名患者 (54%) 病情稳定,只有 4 名患者 (15%) 有疾病进展。使用 shRNA 或 siRNA 沉默 NK 细胞中的 NKG2A 可以抑制抑制信号,进而增强 NK 细胞对体外和体内表达 HLA-E 的癌细胞的细胞毒性。TIGIT 是另一种与 CD155 结合的 NK 细胞检查点受体,通过基因敲除或使用单克隆抗体来阻断 TIGIT 已经被证明可以释放 NK 细胞对脊髓灰质炎病毒的细胞毒性。在各种临床前小鼠模型中发现肿瘤控制细胞因子信号抑制因子 (SOCS) 家族蛋白在 NK 细胞生物学中发挥着重要作用,SOCS 家族蛋白的成员 CISH 基因编码的 CIS 分子是 NK 细胞中一个重要的检查点分子,将 CAR19/IL-15 转导和 CISH 缺失的 NK 细胞注射入在移植淋巴瘤小鼠模型中能够增强其抗肿瘤活性。总体而言,在 NK 细胞抗肿瘤的机制中,NK 细胞抗肿瘤活性与增强 Akt/mTORC1 和 c-MYC 信号通路和增加有氧糖酵解有关,因此,促进 NK 细胞的代谢,能够赋予 NK 细胞更明显的抗肿瘤活性。
针对 TME
利用 CAR 工程赋予 NK 细胞特异性
CAR 结构
CAR-NK 细胞治疗的临床前数据
CAR-NK 细胞的临床研究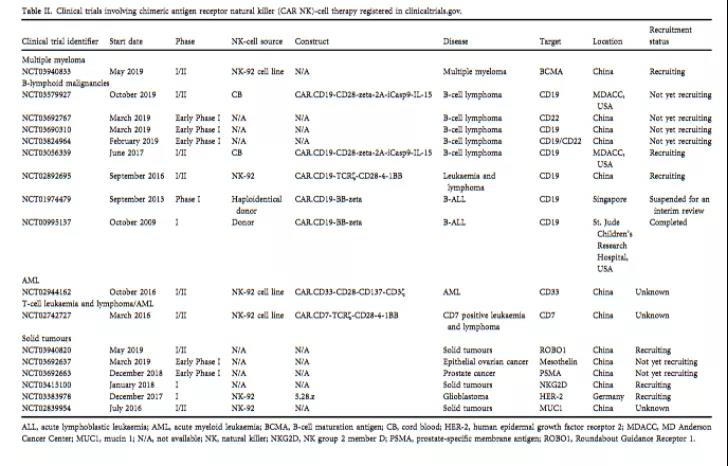
总结
来源:默赛尔生物微信平台
主编:默赛尔生物研发部
E-mail:wechat@morecell.com.cn
摘要
嵌合抗原受体 (CAR) T 细胞是一种迅速崛起的癌症治疗方法,在难治性淋巴恶性肿瘤中发挥了显著的作用。然而,它们的广泛临床应用受到细胞因子释放综合征、神经毒副作用、自体 CAR-T 细胞的成本和治疗时间以及异体 CAR-T 细胞相关的移植物抗宿主病 (GvHD) 风险的限制。自然杀伤细胞 (NK) 由于其来源的稳定性和安全性,已成为具 CAR-T 治疗后的又一个具有广阔前景的细胞免疫疗法。NK 细胞作为免疫系统中抵抗病原体和癌细胞的第一道防线。通过产生细胞因子并介导细胞毒性,且不需要事先致敏,同时与其他免疫细胞相互作用并激活其他免疫细胞发挥功能。用于免疫治疗的 NK 细胞来源广泛,如扩增的自体或异体的外周血、脐带血、造血干细胞、诱导多能干细胞以及 NK 细胞系等。通过 NK 细胞表达 CAR 的基因在许多临床前研究和临床试验中都展现了可喜的疗效。在本文,就 CAR - NK 细胞治疗领域的临床前和临床试验,以及面临的挑战提供相关的借鉴和参考。
免疫治疗 NK 细胞的来源
考虑到 NK 细胞在肿瘤生长和转移防御中的关键作用,基于 NK 细胞的免疫疗法,包括 NK 细胞的过继转移,已经被广泛探索。过继免疫治疗所需的 NK 细胞可以来自多种自体或异体来源,包括外周血、骨髓间充质干细胞来源的造血祖细胞、诱导多能干细胞(iPSCs)、人类胚胎干细胞 (hESCs)、脐带血干细胞、NK 细胞系 (如 NK-92) 或记忆样 NK 细胞。而自体 NK 细胞在被 IL-2、IL-12、IL- 15、IL-18 和 I 型 IFN 等细胞因子激活后,在体外具有高度活性,但其临床疗效似乎有限。这种有限的影响可能是由于肿瘤细胞上表达的自体人白细胞抗原 (HLA) 分子抑制自体 NK 细胞。此外,由于整个免疫抑制肿瘤环境,内源性 NK 细胞可能无法对癌细胞保持足够的细胞毒性。因此异体来源的 NK 细胞可能对肿瘤杀伤具有更加显著的疗法,通过对异体来源的 NK 细胞重编程表达 CAR 基因,将能够缓解自体来源 NK 细胞功能受限的弊端,从而开发出更有效的 NK 细胞来治疗癌症。
利用基因工程改造 NK 细胞
在过去的十年里,基因工程和基因编辑领域取得了巨大的进展。这些工具已被用于优化 NK 细胞的治疗潜力,包括通过细胞因子的表达改善其体内增殖和持久性,通过表达激活型受体来增加其细胞毒性,以及靶向免疫抑制的 TME 等。
增强 NK 细胞的增殖和持久性
利用基因工程改造 NK 细胞使其持久分泌细胞因子如或 lL- 2 或 lL- 15,促进其在体内的存活时间,如通过逆转录病毒将膜结合 (mb)IL- 15 转导 NK 细胞使其分泌 IL-15 可改善 NK 细胞在体内的增殖和持久性。
针对免疫检查点
以免疫检查点为基础的疗法,已经在一些癌症患者中取得了重大的临床进展和长期缓解和可能的治愈的前景。许多研究证据表明靶向 NK 细胞中的检查点对肿瘤治疗具有重要作用。NKG2A 是一种抑制受体,采用抗 NKG2A 单克隆抗体与西妥昔单抗联合在一项 II 期试验中用于 26 例头颈部难治性鳞状细胞癌患者,其中 8 名患者获得部分缓解 (31%),14 名患者 (54%) 病情稳定,只有 4 名患者 (15%) 有疾病进展。使用 shRNA 或 siRNA 沉默 NK 细胞中的 NKG2A 可以抑制抑制信号,进而增强 NK 细胞对体外和体内表达 HLA-E 的癌细胞的细胞毒性。TIGIT 是另一种与 CD155 结合的 NK 细胞检查点受体,通过基因敲除或使用单克隆抗体来阻断 TIGIT 已经被证明可以释放 NK 细胞对脊髓灰质炎病毒的细胞毒性。在各种临床前小鼠模型中发现肿瘤控制细胞因子信号抑制因子 (SOCS) 家族蛋白在 NK 细胞生物学中发挥着重要作用,SOCS 家族蛋白的成员 CISH 基因编码的 CIS 分子是 NK 细胞中一个重要的检查点分子,将 CAR19/IL-15 转导和 CISH 缺失的 NK 细胞注射入在移植淋巴瘤小鼠模型中能够增强其抗肿瘤活性。总体而言,在 NK 细胞抗肿瘤的机制中,NK 细胞抗肿瘤活性与增强 Akt/mTORC1 和 c-MYC 信号通路和增加有氧糖酵解有关,因此,促进 NK 细胞的代谢,能够赋予 NK 细胞更明显的抗肿瘤活性。
针对 TME
TME 涉及复杂的免疫抑制网络,包括免疫细胞、肥大细胞、细胞因子、代谢物和调控途径。TGF-b 是 TME 中重要的免疫抑制因子。工程 NK 细胞表达 TGF-bR2 来源的转导受体,能够中和 TGF-b 对 NK 细胞的负面作用,恢复 NK 细胞的细胞毒性;另一种策略是靶向被 TGF-b 上调的 microRNA (miRNA) miR-27a-5p,通过抑制 miR-27a-5p 的表达可在体内外增加 NK 细胞的效应功能。腺苷是 TME 的另一种免疫抑制代谢物,它是在缺氧和应激反应中由外核酸酶 CD73 和 CD39 产生的,在黑素瘤、乳腺癌和纤维肉瘤的小鼠模型中,阻断 NK 细胞上高亲和力 A2A 腺苷受体增强了 NK 细胞的增殖和成熟以及抗肿瘤活性。而 MDSCs 也是一种免疫调节剂,可抑制抗肿瘤免疫反应,将 NK 细胞免疫治疗与 MDSC 缺失相结合的方法可能会进一步改善 NK 细胞对肿瘤的应答;此外,Treg 也是有吸引力的治疗靶点,通过不同的机制抑制 NK 细胞的活性,包括 TGF-b 的产生和抑制 IL-2 作用于 NK 细胞;通过靶向 MDSCs 和 Tregs 以及结合化疗和联合 NK 细胞免疫治疗方案在多项临床前研究中都取得了显著的疗效,但是,这些化疗药物具有广泛的免疫抑制作用,因此需要新的技术来特异性地、有效地靶向和消除 MDSCs 和 Treg。总之,重编程 NK 细胞以规避 TME 的免疫逃避机制是一种有前途的治疗方案来提高 NK 细胞治疗的疗效。
利用 CAR 工程赋予 NK 细胞特异性
NK 细胞是继 CAR -T 细胞治疗后明显有优势的候选细胞,因为它们的寿命很短,在体内可以持续近 2 周,而且它们不同的细胞因子可以降低过继移植后的毒性风险;此外,NK 细胞的其他优势与它们通过自身受体识别和靶向肿瘤细胞的内在能力有关,这使得它们即使在抗原逃逸机制如 CAR 靶向抗原下调发生时也能杀死癌细胞。重要的是,临床前和临床数据都表明,异体 CAR-NK 细胞引起 GvHD 的风险应该是最小的。这些独特的特性,包括可以较低成本生产的现成产品的潜力,使 NK 细胞成为具有广阔应用前景的细胞治疗产品。
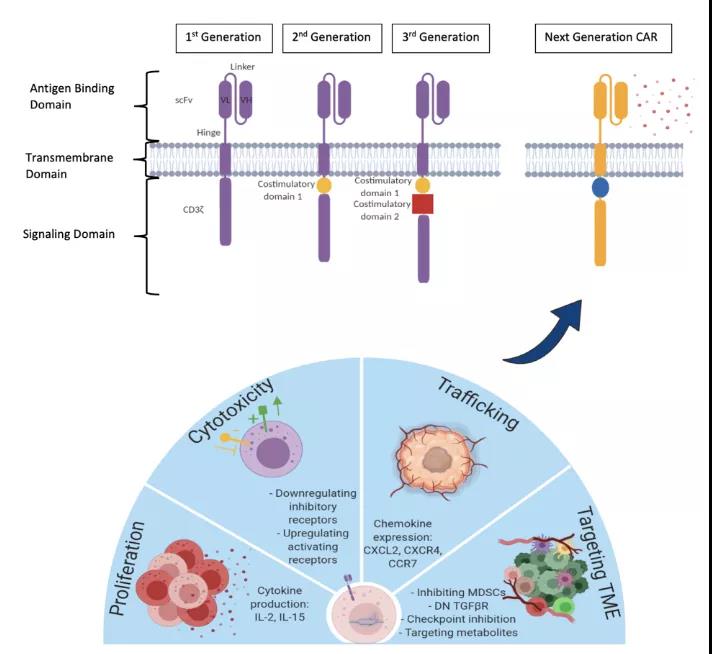
CAR 结构
用于设计 NK 细胞的 CAR 结构有四个基本成分: 一个特异性结合抗体的 scFv,一个细胞外结构域,一个跨膜结构域和一个来自 CD3ζ 免疫受体酪氨酸激活基元 (ITAMs) 的细胞内信号结构域。基因工程领域的进展推动了下一代靶向肿瘤结合能力更强、抗肿瘤活性更强的 CARs 的发展。第一代 CARs 只携带一个胞内信号区,第二代 CARs 包含一个信号域和一个共刺激域,如 CD28 或 4-1BB (CD137), 第三代 CARs 包含一个信号域和多个共刺激域,而第四代 CARs 结合了创新的方法,旨在缓解 CARs 使用面临的挑战,包括增殖差、持久性有限、细胞因子分泌不佳和靶向抗原丢失等,这些创新的方法包括基因敲除或敲入,细胞因子过表达,多个 CARs 同时表达或引入自杀基因来增强 CAR-NK 细胞的安全性和有效性。

利用基因工程策略改造 NK 细胞的下一代嵌合抗原受体 (CARs)
CAR-NK 细胞治疗的临床前数据
CAR-NK 细胞的临床前研究最初研究了抗 CD19 和抗 CD20 CAR-NK 细胞对 B 细胞恶性肿瘤的安全性和有效性。随着,对 CAR-NK 细胞的多项临床前研究发现,急性髓性白血病细对 NK 细胞介导的杀伤非常敏感,因为它们表达许多由 NK 细胞激活受体识别的配体。因此,CAR-NK 细胞可能通过其天生的识别和靶向 AML 细胞的能力,克服一些与抗原逃逸和肿瘤异质性有关的挑战。最近的一项研究中,经含有抗 CD123 的自灭活 α -逆转录病毒载体转导的原代人 NK 细胞,并经 CD28 和 4-1BB 的双重共刺激,在体外有效地杀死 AML 细胞株和原代 AML 母细胞。骨髓瘤细胞也对 NK 细胞介导的杀伤高度敏感,因为它们表达多种 NK 细胞受体的配体。因此,开发靶向骨髓瘤抗原如 CS1、CD138 和 b 细胞成熟抗原 (BCMA) 的 CAR-NK 细胞对治愈骨髓瘤具有广阔的前景。尽管在治疗血液恶性肿瘤方面取得了进展,但是一些挑战限制了 CAR-NK 细胞疗法在实体肿瘤治疗方面的应用其中包括缺乏特异性的靶向抗原,由物理和功能障碍造成的限制,这些限制阻止了 CAR-NK 细胞有效的运输和渗透到以缺氧、酸性 pH 值、营养消耗和免疫抑制为特征的肿瘤组织中。CAR-NK 细胞也被用于靶向实体肿瘤抗原,如人表皮生长因子受体 2 (HER-2) 特异性 CAR-NK 细胞(HER-2, C6.5-scFv-Fc-CD3f-CD28) 被证明在小鼠卵巢癌模型中介导了有效的体外和体内活性,表皮生长因子受体 (EGFR) 重定向的 CAR-NK 细胞在异种移植小鼠模型中可以有效地靶向胶质母细胞瘤。然而,CAR-NK 细胞也容易受到肿瘤的逃避策略的影响。一项研究报道,表达第二代或第三代神经节苷脂抗原 (GD2) CAR- NK 细胞可以在体外杀死多个 GD2+癌细胞株,但在异种移植小鼠模型中无法控制肿瘤。尤文肉瘤细胞上 HLA-G 的上调,抑制 NK 细胞的激活,从而导致肿瘤的免疫逃逸。克服实体肿瘤多重挑战的新方法是将 CAR 细胞与溶瘤病毒结合,溶瘤病毒通过多种机制与 CAR 细胞协同,包括直接溶解 CAR 抗原阳性和阴性癌细胞,以及释放炎症细胞因子,可以将免疫「冷」肿瘤转变为「热」肿瘤。在乳腺癌脑转移小鼠模型中,在 EGFR 转导的 NK-92 细胞中加入溶瘤病毒可进一步增强其抗肿瘤反应。总之,尽管 CAR-NK 细胞在实体肿瘤中的临床前数据令人欣喜,但将其成功转化到临床需要进一步探究肿瘤细胞和 NK 细胞之间潜在的阻断相互作用,并制定相应的策略来提高 CAR-NK 细胞对肿瘤的杀伤能力。
CAR-NK 细胞的临床研究
在过去的一年里,使用 CAR-NK 细胞靶向血液系统恶性肿瘤和实体癌症的临床试验数量迅速增加。一组报道了一项 I 期研究的结果,该研究对三名复发或难治性 AML 患者进行了抗 CD33 CAR NK-92 细胞的治疗,该细胞被转导了含有 CD28 和 4-1BB 的第三代 CAR 结构,该研究证实了 CAR 转染的 NK-92 细胞输注剂量不断增加的安全性;然而,没有取得持久的反应,辐射可能减弱了 CAR-NK 细胞的持久性和细胞毒性。此外,CAR - NK 细胞靶向的临床研究包括靶向 B 细胞恶性肿瘤 (NCT02892695) 的 CD19, 白血病和淋巴瘤 (NCT02742727) 的 CD7、多发性骨髓瘤 (NCT03940833) 中的 BCMA、AML (NCT02944162) 中的 CD33、结直肠癌、胃癌、胰腺癌、乳腺癌、非小细胞肺癌和胶质瘤 (NCT02839954) 中的 MUC1、前列腺癌 (NCT03692663) 中的 PSMA、胶质母细胞瘤 (NCT03383978) 的 HER-2,卵巢癌 (NCT03692637) 中的间皮素等正在多个研究中心开展相关研究。

在临床试验中注册的涉及嵌合抗原受体自然杀伤(CAR - NK)细胞治疗的临床试验
总结
NK 细胞是一种强大的天然免疫细胞,具有独特的特性,使其成为癌症免疫治疗的理想候选细胞。NK 细胞来源广泛,在过去 15 年的多个临床研究中也验证了不同来源的 NK 细胞是安全可靠的。虽然与 CAR-T 免疫治疗相比,CAR-NK 细胞的临床前和早期临床结果令人鼓舞,,但 CAR-NK 细胞治疗领域仍处于起步阶段,许多问题仍有待解决。这些包括确定用于免疫治疗的 NK 细胞的最佳来源,最佳的载体系统,最具生物学相关性的 CAR 激活域和理想的体外扩增策略等等。在不久的将来,我们将可能看到一系列组合策略用于 NK 细胞的治疗应用,以提高其持久性和转移能力,增强其细胞毒性,同时保证安全性,并增强 NK 细胞在 TME 中发挥肿瘤杀伤能力。
深圳市默赛尔生物医学科技发展有限公司是为生物技术公司、医疗机构、高校、科研院所提供全领域细胞治疗产品和系统性技术解决方案的国.家.级.高新技术企业。公司有以细胞提取、储存、复苏、分离到培养全流程所需的专利技术产品。
默赛尔生物自主研发生产的 NK 细胞培养套装(1 盒 NK 细胞培养试剂盒+2L 自然杀伤细胞无血清培养基)具有以下产品优势:
1. 自然杀伤细胞培养试剂盒选用 GMP 级的人源化细胞因子,提高了临床应用的安全性;
2. 自然杀伤细胞无血清培养基不含任何动物血清、外源生长因子或不明成分的添加剂,临床应用安全性高;
3. 采集外周静脉血约 30 ml,14 天内可使 NK 细胞扩增 500 倍以上,细胞终数量 >50 亿;
4. 自然杀伤细胞无血清培养基获得 II 类医疗器械注册证(粤械注准 20202401929)。
深圳市默赛尔生物医学科技发展有限公司是为生物技术公司、医疗机构、高校、科研院所提供全领域细胞治疗产品和系统性技术解决方案的国.家.级.高新技术企业。公司有以细胞提取、储存、复苏、分离到培养全流程所需的专利技术产品。
默赛尔生物自主研发生产的 NK 细胞培养套装(1 盒 NK 细胞培养试剂盒+2L 自然杀伤细胞无血清培养基)具有以下产品优势:
1. 自然杀伤细胞培养试剂盒选用 GMP 级的人源化细胞因子,提高了临床应用的安全性;
2. 自然杀伤细胞无血清培养基不含任何动物血清、外源生长因子或不明成分的添加剂,临床应用安全性高;
3. 采集外周静脉血约 30 ml,14 天内可使 NK 细胞扩增 500 倍以上,细胞终数量 >50 亿;
4. 自然杀伤细胞无血清培养基获得 II 类医疗器械注册证(粤械注准 20202401929)。
参考文献: Chimeric antigen receptor (CAR) natural killer (NK)-cell therapy: leveraging the power of innate immunity. Br J Haematol. 2021 Apr;193(2):216-230.
https://doi: 10.1111/bjh.17186.
来源:默赛尔生物微信平台