深圳市默赛尔生物医学科技发展有限公司
6 年
手机商铺
- NaN
- 0.7000000000000002
- 0.7000000000000002
- 1.7000000000000002
- 0.7000000000000002
推荐产品
公司新闻/正文
比较两种诱导方案对iPSCs来源NK细胞的表型和细胞毒性的影响
11743 人阅读发布时间:2025-09-05 17:40
从诱导多能干细胞(iPSCs)中生成自然杀伤(NK)细胞的能力,为同种异体免疫治疗细胞产品的大规模生产提供了新机遇,并为“即取即用”癌症免疫疗法的发展开辟了新路径。然而,iPSCs向NK细胞的分化过程尚不明确,尤其是关于体外生成的iPSC来源NK(iNK)细胞的发育表观以及所采用的分化方案对iNK细胞表型的影响。为了探讨这一问题,使用两种不同的方案对来自同一个iPSC系的两种iNK细胞进行了比较分析:一是短期、适合临床的无饲养层方案,对应原始造血过程;二是基于淋巴样发育的方案,代表确定性造血阶段。研究显示,两种方案均能生成功能性iNK细胞。但是,两组生成的iNK细胞在表型和转录组学特征上存在明显差异。基于淋巴样发育的分化方法产生的iNK细胞具有更成熟和激活的表型,与短期无饲养层条件下生成的iNK细胞相比,对癌细胞系表现出更高的细胞毒性。这表明在设计基于iNK细胞的过继免疫疗法时,分化策略是需要考虑的重要因素。
实验方法
细胞系
K562细胞在含有10%胎牛血清(FBS)(Gibco, #26140079)和1%青霉素/链霉素(Peni-Strep)(Gibco, #15140130)的RPMI 1640培养基(Gibco, #1875093)中维持,置于5% CO2培养箱中。OP9-DLL4细胞在含有20% FBS和1%青霉素/链霉素的α-MEM培养基(Gibco, #12571063)中维持,置于5% CO2培养箱中。通过Ficoll离心法从匿名人类捐赠者获得外周血单个核细胞(PBMCs)。使用RosetteSep(StemCell Technologies, #15025)纯化NK细胞。Lenti-X 293T细胞系按照Imeri等人2024年的方法培养(37)。简而言之,Lenti-X 293T细胞系在补充了10% FBS的Dulbecco’s Modified Eagle’s Medium(DMEM)中培养。
iPSC培养
iPSC系由iPSC治疗中心(CiTHERA, Genopole)生成。本研究使用的iPSC系(PB68)是通过使用仙台病毒(ThermoFisher, #A16517)从健康捐赠者的PBMCs中衍生出来的。生产并鉴定了一个克隆(PB68.6)的主细胞库。通过FACS分析Oct4、Nanog、Tra1-60和SSEA4标记的表达来评估多能性。通过将3x10^6个iPSCs注射到6周大的NOD/SCID小鼠(Charles River Laboratories)的肌肉内,然后进行畸胎瘤形成实验来评估多能性。十周后,解剖畸胎瘤并固定在4%多聚甲醛中,包埋在石蜡中并用苏木.精和伊红染色,以评估外胚层、内胚层和间胚层组织的存在。通过常规核型分析(46 XY)确认基因组完整性。PB68.6系在含有Geltrex(Gibco, #A1413202)的Essential 8 Flex培养基(Gibco, #A1517001)中培养。在细胞融合时,使用含有0.5 mM乙.二胺四乙酸(EDTA)(Invitrogen, #15575020)的磷酸盐缓冲盐水(DPBS)(Gibco, #14190144)溶液进行传代。
自然杀伤细胞分化方案
无饲养层iPSC来源iNK细胞(无饲养层iNK)的分化根据H. Zhu等人2019年的方案进行。简而言之,将iPSC的单细胞悬液以每孔8000个细胞的密度接种于含有APEL2培养基(Stemcell Tech, #78062)的96孔板中,并补充细胞因子(40 ng/mL SCF,Stemcell Tech, #78062;20 ng/mL BMP-4,Stemcell Tech, #78211.1;20 ng/mL VEGF-165,Stemcell Tech, #78073.1)和10 μM ROCKi(Y-27632)(Stemcell Tech, #72304)。然后将板以300g离心5分钟,并在37°C、5% CO2条件下培养6天。形成的胚胎体(EBs)转移到含有NK细胞分化培养基(56.6% DMEM和28.3% F12(Gibco, #11765054),15%热灭活人AB血清(Sigma Aldrich, # H3667),1% P/S,1% GlutaMAXTM(Gibco, #35050038),1 μM β-巯基乙醇(Sigma Aldrich, # M3148),1% ITS补充剂(Sigma-Aldrich, I3146),20 mg/L抗坏血酸(Sigma-Aldrich A4403))的6孔板中,并补充细胞因子:20 ng/mL SCF,20 ng/mL IL-7(Stemcell Tech, #78196.1),10 ng/mL IL-15(Stemcell Tech, #78031),10 ng/mL FLT3配体(FLT3L)(Stemcell Tech, #78009),和5 ng/mL IL-3(Stemcell Tech, #78040)(第1周)进行3周的培养。
在饲养层方案中,iPSC来源的iNK细胞(OP9-DLL4 iNK)使用Euchner等人2021年的方案进行了适应性修改。使用EDTA将iPSCs分离,转移到低吸附板中,并在含有10 µM ROCKi(Y-27632)的APEL2培养基中过夜培养,以允许EB的形成。第二天收集EBs,并转移到补充有40 ng/mL BMP-4,10 ng/mL bFGF(Stemcell Tech, #78188.1)和50 ng/mL VEGF的APEL2培养基中。在第4天,再次收集EBs,并转移到补充有50 ng/mL SCF,20 ng/mL Flt3L,20 ng/mL IL-3,和30 ng/mL TPO(Stemcell Tech, #78210.1)的APEL2培养基中。在第14天,收集EBs并转移到补充有20% FBS,20 ng/mL SCF,5 ng/mL FLT3L,5 ng/mL IL-7,和10 ng/mL IL-15的α-MEM培养基中的过度生长的OP9-DLL4基质细胞上。每周将iNK细胞收获并转移到新的OP9-DLL4细胞上。
流式细胞术
细胞用DPBS洗涤后,在100 mL DPBS中加入适量抗体进行孵育。对于细胞内染色,细胞随后用BD Cytofix™(BD, 554655)在室温下固定10分钟,避光,洗涤,并用BD Perm/Wash™(BD, 555028)和细胞内抗体在4°C下共同孵育20分钟。流式细胞术使用BD FACS LSRFortessa™分析仪进行,Miltenyi MACSQuant 10™数据使用FlowJo软件版本10.1(Tree Star, Inc.)进行分析。
增殖分析
NK细胞在含有10% FBS(Gibco, #A5256701)、1% GlutaMAX™补充剂(Gibco, #35050038)和50 UI/mL人IL-2(Miltenyi, #130-097-743)的RPMI 1640培养基中孵育。NK细胞培养过夜后,收获细胞进行Ki67的细胞内染色。
NK细胞扩增实验
使用人工抗原呈递细胞(aAPCs)K562-mbIL21测试NK细胞的扩增能力。aAPCs是通过使用含有膜结合IL-21融合蛋白的慢病毒表达盒产生的,该蛋白由Denman等人2012年描述(38)。为了生产表达mbIL21的慢病毒,使用Lenti-X 293T作为包装细胞系,ps-PAX2.2和pMD2.G分别作为包装载体和包膜载体。简而言之,Lentix-293T细胞通过脂质体3000试剂(ThermoFisher, L3000015)共转染20µg ps-PAX2.2(Addgene)包装载体、10µg pMD2.G(Addgene)包膜载体和30µg由VectorBuilder合成的mbIL21载体。iNK与aAPC以1∶2(iNK∶aAPC)的比例在NK扩增培养基中共培养。每隔两到三天,用半体积培养基更换培养液,并每隔七天以1∶1的比例重新刺激aAPCs。
RNA测序
通过使用RosetteSep™Human NK Cell Enrichment Cocktail(Stemcell Tech, #15025)从健康捐赠者血液中进行负选择,收获原代NK细胞。使用RNeasy Mini Kit(Qiagen, #74104)提取总RNA。使用TrueSeq技术(Illumina)制备总RNA文库,并在Illumina仪器上进行75 pb的双端读取测序。Fastq文件使用STAR算法(版本2.7.6a)与Ensembl参考基因组发布版101进行比对。然后使用RSEM(版本1.3.1)计数读取,并使用R(版本3.6.3)中的DESeq2包(DESeq2_1.26.0)对读取计数进行统计分析,采用DESeq2的标准归一化方法(比率的中位数)和读取和基因的预过滤(唯.一映射到基因组的读取,或最多10个不同位点的计数调整,以及至少在3个不同样本中至少有10个读取的基因)。使用EdgeR版本3.40.2进行有监督的差异基因表达分析,比较实验条件。使用GSEA独立应用程序(版本2-2.2.2.4)进行基因集富集分析,基于Hallmarks MSigDb数据库版本2023。使用Pheatmap R包版本1.0.12绘制表达热图。
转录因子互作预测
基于FANTOM联盟数据库中已知的人类转录因子之间的相互作用,设计了一个R包来收集和测试在人类转录组中发现的差异表达转录因子之间的相互作用。这些分析产生了一个组合分数和一个描述转录因子之间组合的富集网络。
NK细胞发育特征
为了显示NK细胞的发育特征,从免疫发育细胞图谱获得了单细胞转录组数据,并用于分析胎儿骨髓来源和卵黄囊来源的人类NK细胞之间差异表达的基因。然后使用这100个在发育条件下差异表达的基因来区分无饲养层iNKs和OP9-DLL4 iNKs的转录组条件。火山图和表达热图是使用transpipe 1.4.0 R包和limma分析制作的。
脱颗粒实验
用CD56-BV421染色的NK细胞与癌细胞靶标K562细胞以1:2的效应器与靶标比例共同孵育。在每个孔中加入CD107a-PEVio770抗体并孵育1小时。随后加入Monensin(BD GolgiStop™蛋白转运抑制剂,BD Biosciences,#554724)和Brefeldin A(BD GolgiPlug™蛋白转运抑制剂,BD Biosciences,#555029),继续孵育2小时。通过对照无靶细胞共培养的NK细胞和PMA/离子霉素阳性对照的数据标准化后,评估CD107a的表达。
ELISA实验
NK细胞与癌细胞靶标K562细胞以1:2的效应器与靶标比例过夜孵育。根据制造商的说明,使用IFN-γELISA试剂盒(ThermoFisher,#KAC1231)和Granzyme B ELISA试剂盒(ThermoFisher,#BMS2027-2)检测上清液。低于检测限的结果在统计时视为0。
细胞毒性实验
通过首先用CellTrace Yellow(ThermoFisher Scientific,#C34567)对靶细胞表面进行染色,然后使用Annexin V进行染色,来评估NK细胞诱导的细胞毒性。对于CellTrace染色,细胞在PBS中以每10^6个细胞/mL 1 μL的量加入染料,在37°C下孵育20分钟。染色后的靶细胞与iNK细胞以不同比例共培养2小时,随后按照制造商的说明用Annexin V–APC(ThermoFisher Scientific,#88-8007-74)进行染色。简而言之,细胞用1X结合缓冲液洗涤,离心,并在含有Annexin V –APC的结合缓冲液中重悬。孵育15分钟后,细胞再次洗涤并通过FACS分析。
实验结果
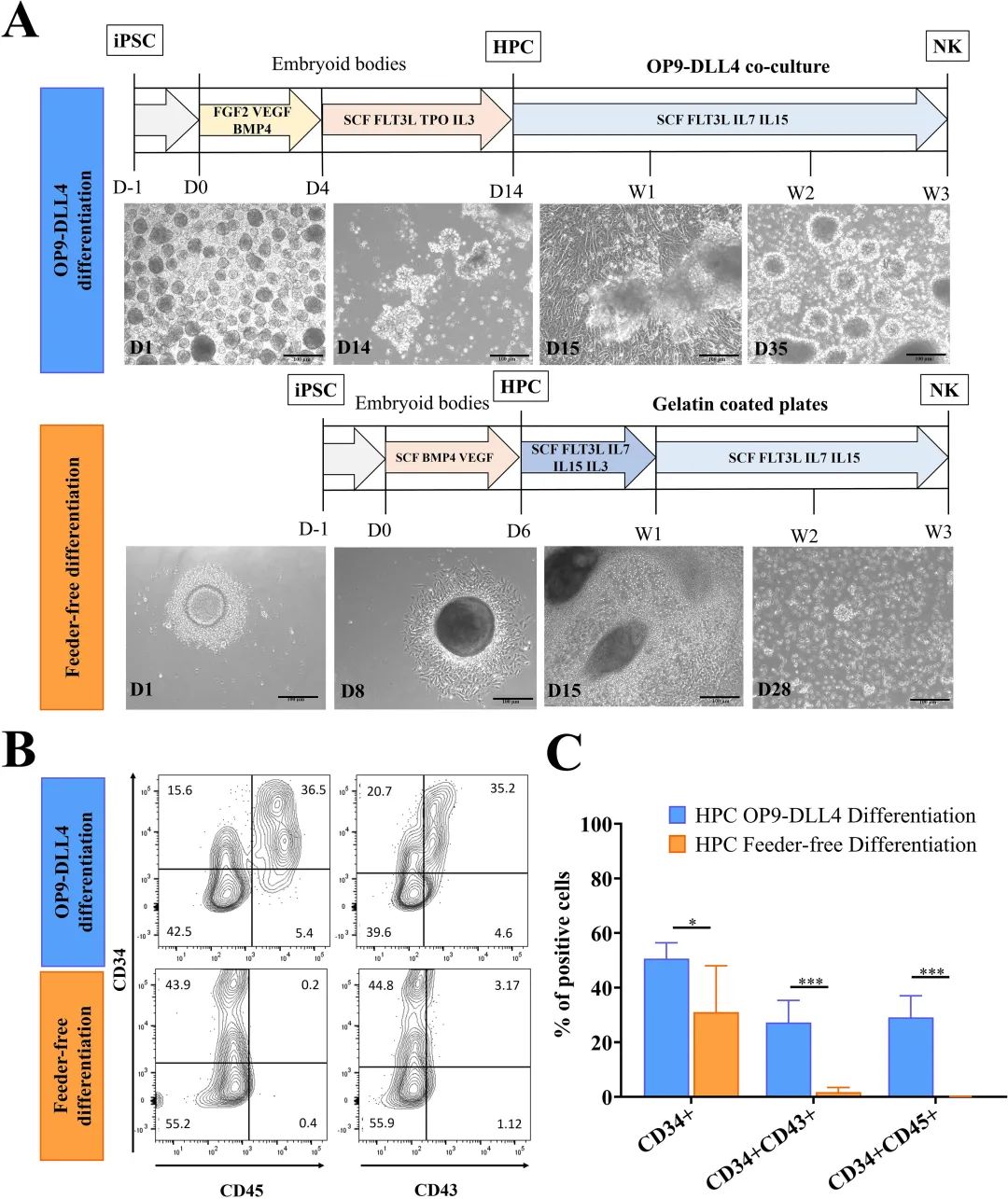
使用淋巴样和无饲养层方案都生成具有高NK潜力的造血祖细胞。
通过两种不同的方法诱导造血祖细胞(HPCs)的分化:一是OP9-DLL4方案,其中通过在超低吸附(ULA)板中的自聚集形成3D胚胎体(EBs);二是无饲养层方案,该方案使用单细胞悬液的旋转聚集(见下图A)。然后根据CD34、CD45和CD43表面标志物的表达,在D14(OP9-DLL4)或D6(无饲养层)时评估HPCs的剖面。两种方案都能产生CD34+细胞:OP9-DLL4方案为50.3 ±5.8%,无饲养层方案为27.9 ±15.2%(P值<0.05)。然而,CD45和CD43仅在通过OP9-DLL4方案衍生的细胞中发现(31.1 ±6.1% CD34+CD45+和28.8 ±7.1% CD34+CD43+;见下图B,C)。由于不需要富集HPCs,未消化的D14 EBs(OP9-DLL4)和未消化的D6 EBs(无饲养层)随后被置于NK分化条件下。为了更好地理解分化动力学,每周监测CD34、CD45和NK谱系标志物CD56的表达。如预期所示,在两种方案中,分化过程中造血祖细胞标志物CD34的表达减少,而泛成熟造血标志物CD45和NK标志物CD56的表达比例增加。还每周监测整个分化过程中淋巴祖细胞的出现。在使用OP9-DLL4方案进行NK分化7天后,出现了少量的[CD34+]CD7+CD45RA+/-细胞亚群。这个亚群似乎在NK分化的第二周消失。
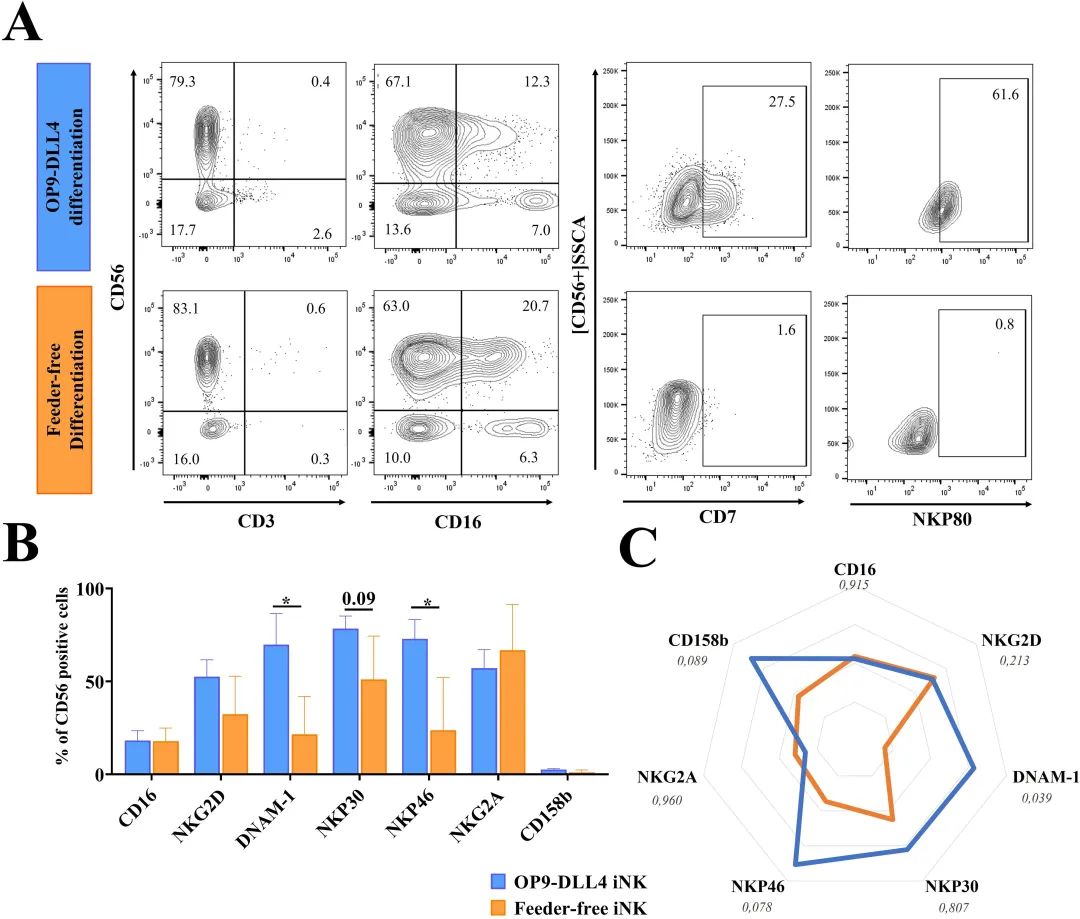
两种方案均能生成成熟的iNK细胞,但具有不同的表型
由两种方案生成的iNK细胞均表达典型的NK标志物CD56+CD16-和CD56+CD16+,且CD3阴性(见下图A)。CD16(FcγRIII)负责NK细胞特有的抗体依赖性细胞介导的细胞毒性(ADCC)。这个标志物通常在成人血液循环中成熟阶段5的NK细胞上表达。有趣的是,研究发现,来自两种方案的iNK细胞在CD56+群体中表达水平相似(OP9-DLL4 iNK细胞为18.3 ±9.1%,无饲养层iNK细胞为17.9 ±6.1%)(见下图B)。NKp80,标志着阶段4b成熟和细胞毒性NK细胞,在多达61.6%的OP9-DLL4 iNK细胞中可检测到,但在终末分化的无饲养层iNK细胞中不可检测(见下图A)。与无饲养层细胞相比,OP9-DLL4 iNK细胞显示出不同的表型特征,CD56+群体中阳性细胞的比例显著高于DNAM-1(OP9-DLL4 iNK细胞为69.8 ±28.9%,无饲养层iNK细胞为21.5 ±17.6%,P值<0.05)和NKp46(OP9-DLL4 iNK细胞为72.9 ±17.9%,无饲养层iNK细胞为23.7 ±24.6%,P值<0.05)。相反,受体NKP30、NKG2A和NKG2D在两种方案中的表达相似。两组iNK细胞也低水平表达KIR受体2DL2-3(CD158b)(OP9-DLL4为2.6 ±0.7%,无饲养层为1.1 ±1.1%)(见下图B)。为了更好地评估iNK分化终点时CD56+细胞群体的特征,通过平均荧光强度(MFI)测量了标志物的相对表达(见下图C)。与OP9-DLL4 iNK细胞相比,无饲养层iNK细胞表现出普遍较低的表达特征,DNAM-1的表达减少(P值<0.05),NKP46的表达相对较低(尽管无统计学意义,P值<0.08)。总的来说,这些结果表明,与无饲养层iNK细胞相比,OP9-DLL4 iNK细胞展现出更成熟的、淋巴样启动的表型,并表达较高水平的活化受体,如NKP46和DNAM-1。
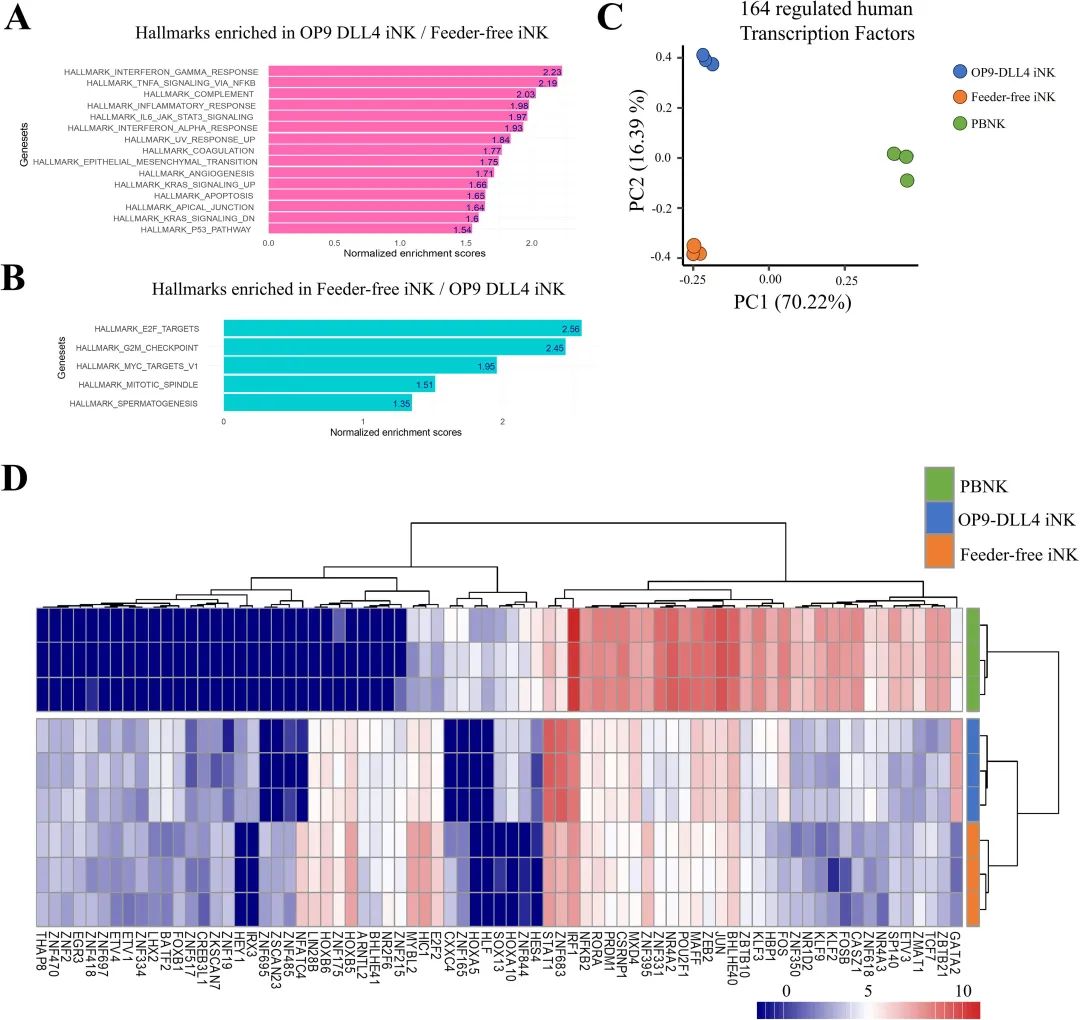
OP9-DLL4 iNK细胞在炎症标志物和参与NK细胞成熟与分化的转录因子方面富集
在其中,识别了如CCL17和CCL1等化学吸引标志物,这些在OP9-DLL4 iNK细胞中上调,以及如GATA2等转录因子。还检测到转录因子NFATC4和免疫检查点LAG3在无饲养层iNK细胞中表达较高。使用标准化转录组数据,进行了基因集富集分析(GSEA),比较了两组不同的iNK细胞,使用了Hallmark基因集数据库。OP9-DLL4 iNK细胞在免疫相关基因集中显著富集,包括参与IFN-γ反应、通过NF-κB的TNF信号传导、补体途径和炎症反应的基因集(见下图A)。相比之下,GSEA揭示无饲养层iNK细胞在与转录调控和细胞周期进展相关的基因集中富集(见下图B)。对这些164个转录因子的表达模式进行无监督主成分分析,能够有效地区分这三组细胞:第一个主轴上70.22%的变异区分了原代NK细胞和iNK细胞。相比之下,第二个主轴上16.39%的变异区分了OP9-DLL4 iNK细胞和无饲养层iNK细胞(见下图C)。
这种分离模式通过基于前75个差异调控转录因子的无监督聚类进一步得到证实(见下图D)。值得注意的是,与无饲养层iNK细胞相比,OP9-DLL4 iNK细胞显著上调了GATA2、FOS、FOSB、JUN、ZEB2和STAT1的表达,而无饲养层iNK细胞与OP9-DLL4 iNK细胞相比,HOXB5、MYBL2、HC1和E2F2的表达增加。此外,对OP9-DLL4 iNK细胞中突出的转录因子的分析揭示了包含IRF1、FOS、STAT1、STAT2、STAT3、HES1和GATA2之间相互作用的全面cistrome的富集,这些因子均已知参与NK细胞的分化和成熟。
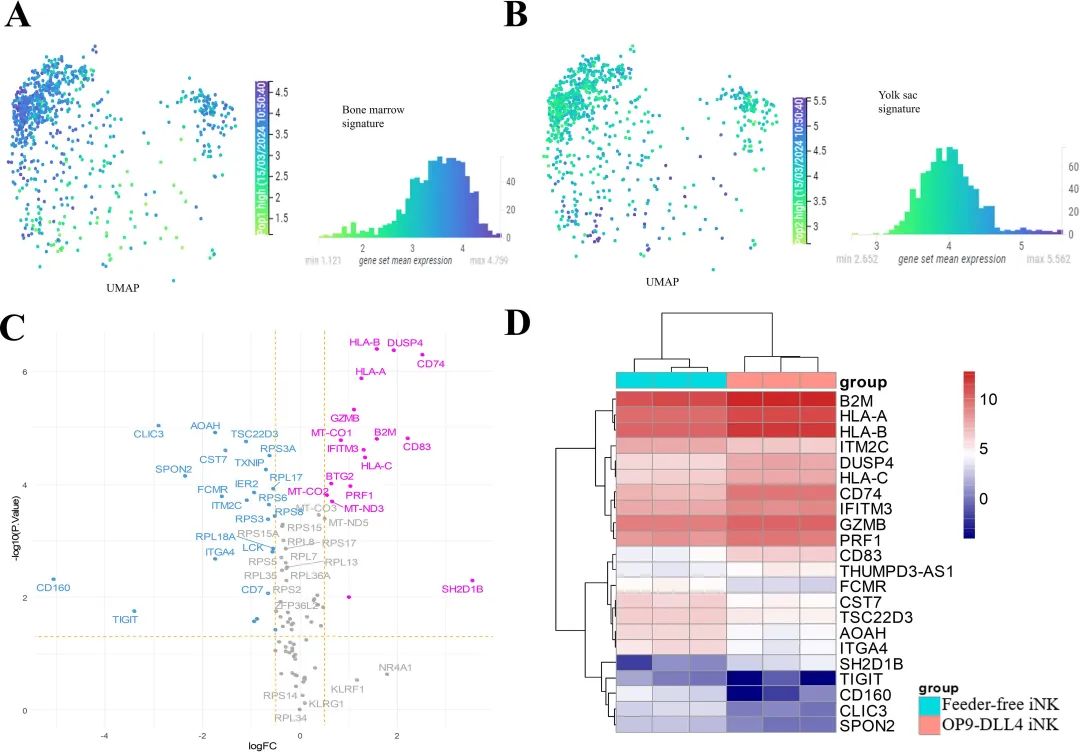
iNK细胞展现出不同的发育模式
为了在胚胎背景下评估生成的iNK细胞,使用免疫发育细胞图谱分析了来自不同解剖部位的NK细胞的特征。具体来说,比较了人类卵黄囊和胎儿骨髓中单细胞转录组数据,使用UMAP降维技术。这种分析揭示了这两个细胞群体之间基因表达特征的显著差异。在降维之后,骨髓NK细胞在人类NK细胞簇的UMAP可视化中被发现集中在左上角(见下图A),而卵黄囊NK细胞则被发现在热图的底部集中(见下图B)。在两种NK身份之间进行了差异表达分析,并在每个细胞群体中确定了前50个差异表达基因(见下图A、B中的直方图)。然后,这个NK发育特征(100个基因)被用来区分iNK细胞转录组(见下图C、D)。发现OP9-DLL4 iNK细胞在HLA、B2M、CD74、GRZB和PRF1等方面更为富集,这些特征是胎儿骨髓NK细胞的标志。这些结果表明,与无饲养层iNK细胞相比,OP9-DLL4 iNK细胞的转录组特征更接近骨髓NK细胞。
OP9-DLL4 iNK细胞对K562细胞系展现出更强的活性
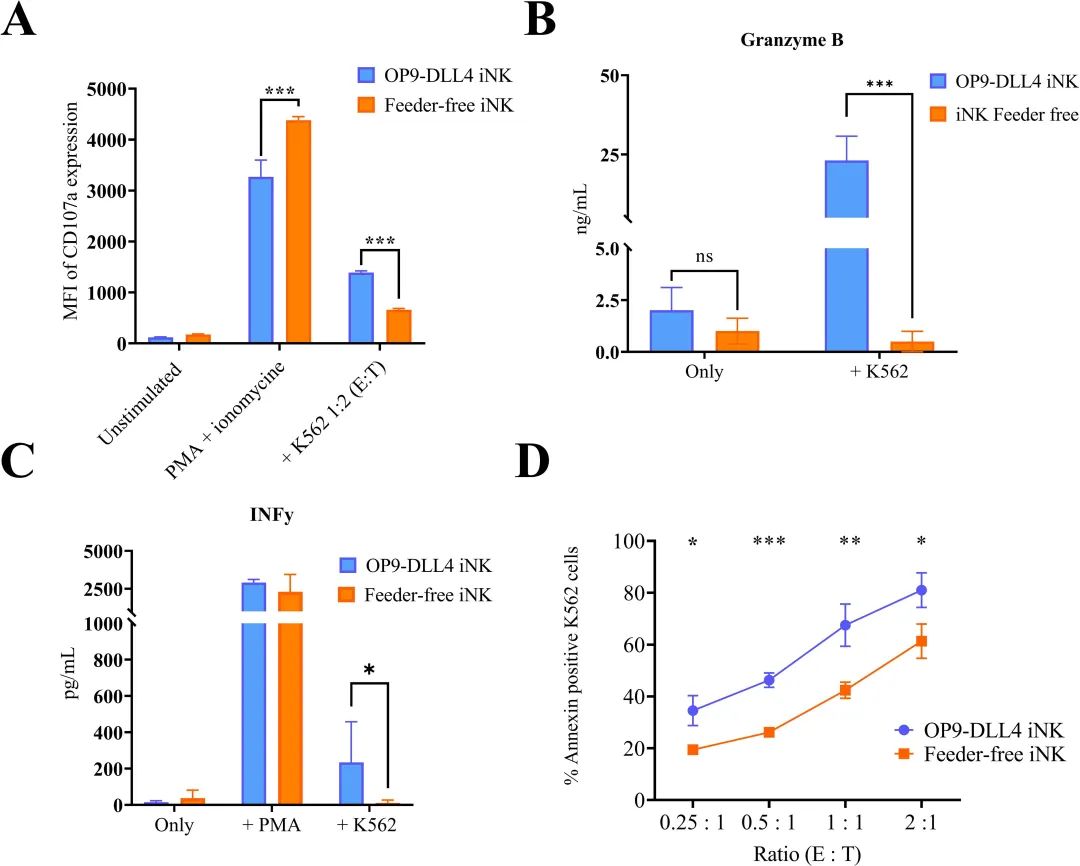
为了评估使用无饲养层和饲养层基础方案生成的iNK细胞的功能性,对这些细胞在与白血病K562细胞共培养后的脱颗粒能力进行了研究。如预期所示,两种方案产生的iNK细胞都能够有效地脱颗粒(在PMA刺激后,阳性控制中有超过80%的细胞)(数据未显示)。在K562细胞刺激后,OP9-DLL4 iNK细胞显示出更高的脱颗粒程度(1388.7 ±35.2 MFI对比无饲养层iNK细胞的657.3 ±29.2 MFI,P值< 0.0001)(见下图A)。通过ELISA实验测量过夜刺激的iNK细胞上清液中颗粒酶B的浓度来证实这一结果。如预期,OP9-DLL4 iNK细胞在上清液中的颗粒酶B浓度远高于无饲养层iNK细胞(分别为23.1 ±0.5 ng/mL和0.5 ±0.4 ng/mL,P值< 0.0001)(见下图B)。同样,使用ELISA实验来测量过夜刺激后上清液中IFN-γ的分泌,刺激物为PMA或K562细胞。两种类型的iNK细胞对PMA刺激都显示出强烈的IFN-γ反应(OP9-DLL4 iNK细胞为2914.4 ±140.0 pg/mL,无饲养层iNK细胞为1929.9 ±1104.3 pg/mL)。然而,在K562细胞刺激后,OP9-DLL4 iNK细胞的IFN-γ分泌量远高于无饲养层iNK细胞(分别为234.1 ±193.9 pg/mL和0.1 ±0.03 pg/mL,P值< 0.05)(见下图C)。最后,为了评估这些iNK细胞的短期细胞毒性潜力,评估了与K562细胞以不同效应器与靶标比例(0.25:1,0.5:1,1:1和2:1)共培养后导致的凋亡细胞比例。有趣的是,观察到在所有比例中,与OP9-DLL4 iNK共培养的凋亡细胞比例要高得多(见下图D)。总的来说,的数据表明,在与K562癌细胞系的体外实验中,OP9-DLL4 iNK细胞在功能性方面更为优越。
结论
在本研究中,基于淋巴样饲养层的iNK细胞在功能性方面优于使用无饲养层协议生成的iNK细胞。转录组分析为NK细胞分化提供了新的见解,揭示了改善分化过程的潜在途径,特别是通过激活Notch信号通路。另外,尽管无饲养层分化协议在临床上具有吸引力,但该类方案还需要进一步的发展,来产生更成熟和功能性的NK细胞,以满足医疗用途的需求。
DOI:10.3389/fimmu.2024.1463736