深圳市默赛尔生物医学科技发展有限公司
6 年
手机商铺
- NaN
- 0.7000000000000002
- 0.7000000000000002
- 1.7000000000000002
- 0.7000000000000002
推荐产品
公司新闻/正文
CD8+T细胞亚群在抗肿瘤免疫中的作用
10634 人阅读发布时间:2025-07-08 13:51
效应CD8+T细胞通常被认为是同质性的细胞毒性细胞群,主要产生干扰素-γ(IFN-γ)。然而,近期研究挑战了这一观点,因为已经描述了多个CD8+T细胞亚群,每个亚群都具有独特的效应功能和细胞毒性潜力。这些亚群被称为Tc亚群,在肿瘤微环境(TME)中也已检测到它们的存在,它们可能影响抗肿瘤反应和患者预后。在本综述中,我们强调了Tc亚群在TME中的普遍性和作用。同时,我们还讨论了在采用免疫疗法治疗癌症的背景下,这些亚群的治疗应用。
CD8+T细胞:不仅仅是IFN-γ和颗粒酶
免疫系统由多种细胞亚型组成,它们协同作用以保护身体免受病原体和肿瘤的侵害。T细胞在协调整体免疫反应和直接杀伤受损细胞中发挥着重要作用。通常,这些功能分别由CD4+和CD8+T细胞介导。已经鉴定出多种不同的效应CD4+T细胞亚群,每个亚群都具有独特的细胞因子谱、表面标志物、转录组和在疾病中的作用。然而,CD8+T细胞通常被认为是一群均匀的细胞,它们大量分泌IFN-γ和蛋白酶颗粒酶B,这些物质协同作用以杀伤感染或肿瘤生成的细胞。因此,这种观点并没有完全涵盖CD8+效应T细胞池内的多样性。除了调节性和滤泡性CD8+T细胞群体之外,还鉴定出了多种类型的效应CD8+Tc亚群,这些亚群与CD4+Th辅助T细胞亚群相似。每个CD8+Tc亚群在功能上都是独特的,可能在抗肿瘤免疫反应中具有不同的作用。在本综述中,我们提供了每个亚群不同作用的概述,然后重点讨论它们引发的抗肿瘤免疫反应。
CD8+ Tc亚群
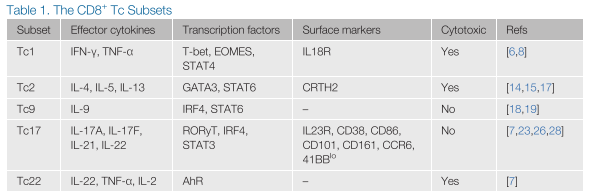
在体外向特定的CD8+Tc谱系分化是由在初始激活幼稚T细胞时存在的一组定义明确的极化细胞因子混合物介导的。这些细胞因子启动信号级联反应,导致特定转录因子的表达,从而促进谱系承诺和采用独特的效应表型。每个Tc亚群都表达不同的细胞因子谱,并且在细胞毒性潜力方面存在意外差异,某些亚群显示出较差的细胞溶解能力。迄今为止,已经鉴定出几种CD8+Tc亚群,包括传统的产生IFN-γ的Tc1亚群、产生白细胞介素(IL)-4的Tc2亚群、产生IL-9的Tc9亚群、产生IL-17的Tc17亚群,以及产生IL-22的Tc22亚群(图1)(表1)。
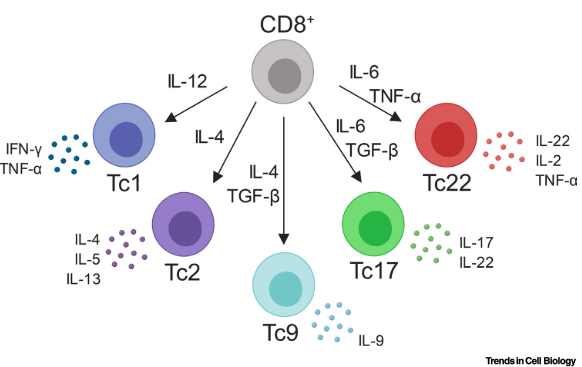
Tc1细胞:典型的细胞毒性T细胞
作为典型的细胞毒性CD8+T细胞,Tc1细胞展现出卓越的细胞毒性活性,并能有效地杀伤肿瘤细胞和携带细胞内病原体的细胞。Tc1细胞的诱导是由细胞因子IL-12介导的,通常在抗原呈递细胞(APCs),包括巨噬细胞和树突细胞,暴露于病原体来源的成熟刺激后产生。功能上,Tc1细胞以其高水平的穿孔素、颗粒酶B、IFN-γ和肿瘤坏死因子(TNF-α)为特征,同时低表达与其他Tc谱系相关的细胞因子,即IL-4、IL-9和IL-17。除了它们的细胞因子谱,Tc1细胞还可以通过细胞表面高表达的IL18R与其他Tc亚群区分开来。 Tc1细胞的极化是由几个关键的转录因子介导的,包括信号传导器和激活转录因子(STAT)4、T-bet和eomesodermin(EOMES)。作为IL-12受体的直接下游,STAT4在上调T-bet方面具有早期作用,它们共同促进IFN-γ的产生。这一过程得到EOMES的支持,EOMES已被证明与T-bet协同作用,进一步增强IFN-γ的产生。事实上,T-bet和EOMES之间的这种协同作用对于Tc1细胞的效应性质至关重要,通过基因敲除研究证明了这一点,这些研究显示,缺乏这两种转录因子的CD8+T细胞在清除病毒感染方面的能力减弱。
Tc2细胞
CD8+Tc2细胞是在Tc1之后第一个被识别的额外的Tc亚群。它们以产生II型细胞因子而闻名,如IL-4、IL-5和IL-13,同时减少IFN-γ的产生。Tc2细胞也表达高水平的颗粒酶B,并展现出强大的细胞毒性能力,与Tc1细胞相当。Tc2细胞的极化是由细胞因子IL-4驱动的,IL-4激活转录因子STAT6和GATA3,促进Tc2谱系所需基因的表达。由于这些细胞分泌大量的II型细胞因子,这些因子可以促进IgE的产生和嗜酸性粒细胞的招募,Tc2细胞在介导过敏反应中发挥重要作用,特别是在呼吸道中。
Tc9细胞
较新描述的Tc亚群之一是CD8+Tc9细胞,它们产生IL-9但相对较少的IFN-γ。然而,鉴于围绕辅助性T细胞(Th)9细胞是否是一个与Th2细胞不同的谱系的观念存在争议,Tc9谱系是否与Tc2细胞不同仍有待完全确定。尽管如此,Tc9细胞的极化条件已经明确,包括细胞因子IL-4和TGF-β的联合作用,这些作用由转录因子STAT6和干扰素调节因子4(IRF4)介导。令人惊讶的是,与Tc1和Tc2细胞不同,Tc9细胞表现出较差的细胞毒性功能,部分原因是它们颗粒酶B的产生有限。Tc9细胞的生物学意义及其缺乏细胞毒性的原因目前尚不清楚。然而,Tc9细胞已经在小肠以及特应性皮炎病变和哮喘患者血液中被检测到,它们被认为可能促进疾病进。
Tc17细胞
产生IL-17的CD8+Tc17细胞是T细胞的一个独特亚群,以其高产生IL-17A、IL-17F和IL-22,同时低表达IFN-γ而闻名。IL-6和TGF-β的组合驱动Tc17细胞的分化,加入IL-1β、IL-21和/或IL-23可以进一步增强这一过程。IL-6信号导致转录因子STAT3和RORγt的激活,这些因子对于向Tc17谱系分化至关重要。与Tc9细胞类似,Tc17细胞也表达低水平的颗粒酶B,并且具有较差的细胞溶解功能。已经在mRNA或蛋白质水平上鉴定出Tc17细胞的几个表面标志物,包括IL-23R、CD38、CD86、CD101、CD103和CCR6。Tc17细胞的生物学意义比许多其他较新的亚群更为明确,这些细胞在人类皮肤组织在稳态条件下以及肿瘤微环境(TME)中已被检测到,被认为对某些真菌病原体具有保护作用。此外,Tc17细胞在自身免疫疾病背景下,包括多发性硬化症,以及移植物抗宿主病反应中发挥了有害作用。除了作为效应细胞外,证据还表明Tc17细胞可以分化为长寿记忆T细胞(框1)。

Tc22细胞
Tc22细胞是CD8+T细胞的一个亚群,主要产生IL-22,而其他谱系定义细胞因子的产生较少,包括IL-17。与Th22细胞类似,是否存在Tc22细胞作为一个独特的T细胞谱系仍存在争议,因为Th17和Tc17细胞也能产生IL-22。Tc22细胞已在炎症病变中检测到,如特应性皮炎和银屑病,它们被认为有助于疾病病理学,在病毒感染反应中,包括HIV,并且已被发现渗透到鳞状细胞癌中。最近的研究发现,IL-6联合TNF-α和一种芳烃受体(AhR)激动剂是Tc22分化的驱动因素。通过基因敲除研究,证明AhR转录因子对于向Tc22谱系承诺至关重要。功能上,Tc22细胞表达颗粒酶B,具有高度细胞溶解性,并在适应性转移研究中提供了卓越的抗肿瘤活性。尽管Tc22细胞的生物学意义仍然相对不明确,但它们可以在人类卵巢癌患者中检测到,它们可以构成从肿瘤中扩增的CD8+T细胞高达35%。
在肿瘤微环境(TME)中的Tc亚群
肿瘤微环境(TME)是一个免疫活动的高峰,其中不同的细胞类型要么促进要么抑制肿瘤的生长。在TME中可以检测到多种免疫细胞,包括CD8+T细胞及其亚群。文献中最常描述的亚群是典型的IFNγ+Tc1细胞,它们已在从各种癌症(包括黑色素瘤、卵巢癌、乳腺癌和肺癌)中分离出来的人类和小鼠肿瘤浸润淋巴细胞(TIL)中被检测到(表2)。Tc1s的存在往往与更良好的预后相关,这可能是由于它们与IFN-γ结合的卓越细胞毒性潜力。在TME中,IFN-γ与激活信号协同作用,上调抗原呈递细胞(APC)上的MHC-I,从而增强肿瘤和引流淋巴结中幼稚T细胞的抗原呈递和激活。此外,IFN-γ还可以帮助重新编程TME中的抑制性细胞,如调节性T细胞(Tregs),以解除肿瘤用来逃避杀伤的一种武器。此外,IFN-γ还直接作用于肿瘤细胞,上调MHC-I,从而增加它们对CD8+T细胞依赖性细胞毒性的敏感性。实际上,IFN-γ对肿瘤细胞的直接作用对抗肿瘤反应至关重要,因为具有IFN-γ受体下游信号分子功能丧失突变的黑色素瘤患者的肿瘤对免疫治疗有抵抗力,这可能是因为免疫编辑的改变。
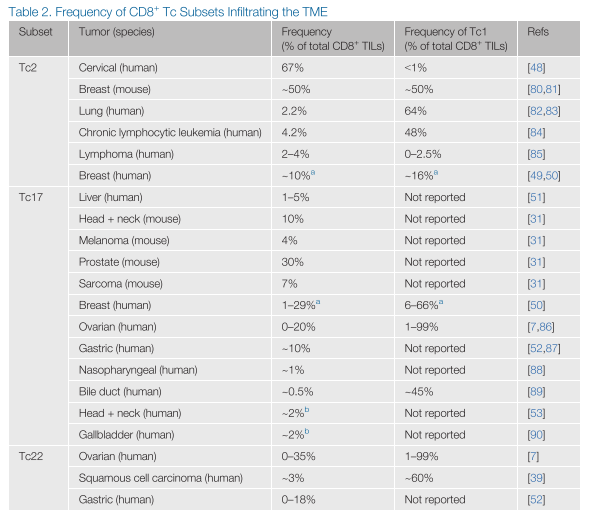
尽管文献主要关注Tc1,但其他Tc亚群也被检测为CD8+TILs的一部分。令人惊讶的是,在一些患者中,除了Tc1细胞之外的亚群占据了CD8+TILs的更大比例(表2)。例如,Sheu及其同事分析了八名宫颈癌患者的CD8+TILs的细胞因子表达模式。使用IFN-γ和IL-5作为Tc1和Tc2细胞的替代标记,他们发现侵入肿瘤的67%的CD8+T细胞是Tc2细胞,而Tc1细胞的比例不到1%。然而,TME中增加的Tc2细胞的临床意义和预后指标目前尚不清楚。在乳腺癌患者中,一些证据表明,肿瘤引流淋巴结(TDLN)中的Tc2:Tc1比例与肿瘤大小无关。相反,Faghih等人证明,这可能与分期有关,因为与II期癌症患者相比,III期乳腺癌患者的TDLN中Tc2细胞数量几乎增加了一倍,而Tc1细胞的比例保持不变。鉴于肿瘤分期与患者生存率呈负相关,Tc2细胞在乳腺癌中也可能与生存率负相关,这一可能性应进一步研究。 多项研究也在多种小鼠和人类肿瘤中检测到了Tc17细胞,如肝细胞癌、黑色素瘤、前列腺癌和胃癌。在庄等人的研究中,胃癌患者的TILs中Tc17细胞的数量在III期和IV期肿瘤中显著高于I期和II期肿瘤。重要的是,TIL中Tc17细胞数量高的患者与Tc17细胞数量低的患者相比,总体生存率显著降低。同样,已有研究表明,头颈部癌症患者中循环Tc17细胞水平高的患者与Tc17细胞水平低的患者相比,总体生存率显著更差。尽管背后的机制尚不明确,但这种不良预后的部分可能是由IL-17介导的。在这种情况下,IL-17可以直接作用于肿瘤细胞或TME中的其他细胞类型,促进抑制性和促血管生成因子的产生,如血管内皮生长因子(VEGF),此外还促进包括中性粒细胞和髓系来源的抑制细胞(MDSCs)在内的可能促进肿瘤生成的细胞类型的招募。实际上,对人类癌症的荟萃分析发现,IL-17水平升高与包括肝细胞癌和肺癌在内的多种癌症的总体生存率降低相关。然而,在某些情况下,如在食管癌中,它也可以是一个积极的预后因素。因此,尽管当前的研究发现提示肿瘤中的Tc17细胞在控制肿瘤生长方面的能力有限,但可能存在一小部分肿瘤,其中Tc17细胞和IL-17的产生可能是有益的。 Tc9和Tc22细胞作为相对较新的亚群,关于它们在TME中的存在和意义的信息较少。尽管如此,Tc22细胞已在胃癌患者和移植相关的鳞状细胞癌患者中被发现。最近,Tc22细胞在大约30%的卵巢癌患者中被发现,它们在扩展的CD8+TILs中占据了高达35%的比例,在某些患者中,它们的数量超过了Tc1或Tc17亚群。重要的是,产生IL-22的CD8+T细胞数量增加的患者,无复发生存期显著延长,这表明这些细胞在卵巢癌中具有潜在的预后意义。综上所述,这一研究和其他研究清楚地表明,除了Tc1细胞,TME中还存在其他亚群,它们在抗肿瘤反应和预后中发挥作用。
肿瘤微环境(TME)在Tc极化中的作用
目前尚不清楚在TME中检测到的Tc亚群是在其他地方极化后被招募到TME中,还是由于TME中存在的因素而在进入TME后发生极化。支持后一种假设的证据表明,TME中可以形成次级淋巴样结构,这些结构积极招募和激活幼稚T细胞。一旦进入肿瘤,幼稚T细胞可能会受到TME中通常高水平存在的细胞因子的影响,如TGF-β,从而促进它们向Tc9和Tc17谱系的发展。此外,幼稚T细胞可能会与TME内的抗原呈递细胞(APCs)以及附近的次级淋巴样结构相互作用,其中许多APCs功能异常,产生改变的细胞因子谱和共刺激分子,这些因素可能影响这些CD8+T细胞的谱系承诺。确实,一项研究发现,从人类肝细胞癌肿瘤中分离出来的巨噬细胞,但在没有外源性极化细胞因子的情况下,与CD8+T细胞在体外培养时,能够产生Tc17细胞。这主要是通过这些肿瘤相关巨噬细胞分泌的IL-1β和IL-23驱动的,它们有助于推动向Tc17谱系的承诺。至于Tc1细胞,结果存在矛盾,因为从TME中分离出来的APCs既能增强也能抑制Tc1分化和IFN-γ的产生。然而,TME内的直接T细胞与APC相互作用相对于淋巴结中的抗原呈递的重要性仍有待澄清。APC细胞是否能在TME内诱导其他Tc亚群也不清楚;然而,已有证据显示,某些APC群体可以优先诱导Tc9和Tc22亚群。也可能现有的Tc亚群在暴露于TME内的因素后,可以从一个亚群转换为另一个亚群。确实,例如Tc9和Tc17细胞的可塑性已经得到证明,因为它们在转移到荷瘤小鼠后可以转换为Tc1表型。总的来说,TME在塑造CD8+T细胞反应中的重要性开始被揭示;然而,未来的研究应该旨在更好地理解涉及的机制以及这些亚群对抗肿瘤反应的影响。
极化T细胞的适应性免疫治疗
利用免疫系统治疗癌症是一种有前景的治疗方法。许多类型的免疫疗法正在积极探索中,成功的策略包括转移表达转基因T细胞受体(TCR)或嵌合抗原受体(CAR)的肿瘤特异性T细胞,以及利用从患者自身肿瘤中分离的T细胞进行的TIL疗法。这些策略的核心是在体外激活和扩增肿瘤特异性T细胞,然后进行适应性转移。寻找增强这一过程的方法是一个活跃的研究领域,其中一种方法是将CD8+T细胞极化为具有强大抗肿瘤特性的Tc亚群。 在识别更新颖的亚群之前,Tc1细胞在这方面是“佼佼者”,因为在多个小鼠适应性转移肿瘤模型中,它们持续优于Tc2细胞。这是出乎意料的,因为在体外,Tc1和Tc2细胞都具有相似的细胞毒性,这在它们的体内抗肿瘤效果中起着重要作用。可能还有其他因素导致Tc2细胞的表现减弱,比如它们产生IL-4。尽管IL-4可以作为生长因子增强T细胞增殖,但IL-4已被证明具有促肿瘤生成效应,这可能有助于抑制Tc2介导的反应。例如,IL-4在促进巨噬细胞向M2表型承诺方面具有已确立的作用,部分表现为它们分泌抑制T细胞功能的抗炎分子。 因此,选择合适的T细胞亚群进行适应性免疫治疗至关重要。Tc1细胞因其强大的细胞毒性和抗肿瘤特性而成为首要选择,但研究人员也在探索其他Tc亚群,如Tc17和Tc22,它们可能通过不同的机制对肿瘤产生作用。例如,Tc17细胞通过产生IL-17等细胞因子,可能有助于改变肿瘤微环境,而Tc22细胞通过产生IL-22可能有助于抑制肿瘤生长和促进组织修复。 未来的研究将需要进一步阐明不同Tc亚群在适应性免疫治疗中的潜在作用,以及如何最佳地利用它们来提高癌症治疗的疗效。这可能包括开发新的策略来极化T细胞,优化它们的扩增条件,以及设计临床试验来评估不同T细胞亚群在患者中的安全性和有效性。 IFN-γ对于Tc2细胞的抗肿瘤效应并不是不可或缺的。这与Tc1和其他Tc亚群形成鲜明对比,因为它们的抗肿瘤功能依赖于它们进入TME后产生IFN-γ的能力。例如,Garcia-Hernandez及其同事的研究表明,将Tc17细胞转移到B16荷瘤小鼠中可以抑制肿瘤生长,尽管效果远不如Tc1细胞显著。这种Tc17依赖性的免疫力部分依赖于它们产生IFN-γ的能力。这表明Tc17细胞表现出一定程度的可塑性(框2)。此外,Tc17的抗肿瘤效果取决于上下文,治疗的成功取决于所使用的模型。例如,在将Tc17细胞转移到已建立的肿瘤小鼠后,观察到的抗肿瘤活性最小。然而,当Tc17细胞与淋巴耗竭、肿瘤抗原疫苗接种和/或体内IL-2治疗相结合时,观察到了强烈的抗肿瘤效果。这可能是由于Tc17细胞具有内在的干细胞特性,因为它们表达高水平的转录因子TCF7,这与增加的寿命和自我更新能力相关。因此,Tc17细胞可能在体内遇到支持性治疗时持续存在并经历强烈的增殖爆发,从而促进抗肿瘤反应。这可能也适用于Tc9细胞,根据最近的研究结果,单独极化的Tc9细胞在治疗已建立的B16肿瘤时显示出较差的抗肿瘤功能。然而,当Tc9细胞与支持性体内治疗(IL-2注射,肿瘤抗原疫苗接种+/-淋巴耗竭)相结合时,Tc9细胞在治疗已建立的黑色素瘤肿瘤方面显示出卓越的效果。因此,可以推测Tc9细胞的功能类似于Tc17细胞,它们在遇到这些支持性治疗时可以持续存在并经历强烈的增殖爆发,但单独使用时缺乏令人满意的抗肿瘤功能。

影响Tc亚群抗肿瘤反应的另一个方面是它们的代谢状态。确实,最近的报告将增加的T细胞生物能量学和线粒体代谢与改善的抗肿瘤反应联系起来。沿着这些线索,研究表明Tc22细胞在B16黑色素瘤肿瘤模型中表现出强烈的抗肿瘤特性,至少与Tc1细胞相当,甚至可能更好。机制上,与Tc1或Tc17细胞相比,Tc22细胞中线粒体蛋白和ATP的增加表明不同亚群之间可能存在代谢差异。除了Tc22细胞外,还有报道称Tc9细胞中的胆固醇代谢也影响其抗肿瘤活性。总的来说,在免疫治疗背景下,每个亚群的功能和代谢特性都与它们的谱系相关,这在设计未来的免疫治疗策略时应予以考虑。
总结
总体而言,很明显,CD8+T细胞不仅仅是它们的细胞溶解能力和产生IFN-γ的能力,将CD8+T细胞简单地称为细胞毒性T细胞是一种误称。确实,已经识别出多个CD8+Tc亚群,每个亚群都具有独特的效应器功能,包括非细胞溶解性亚群。这些亚群已在肿瘤微环境(TME)中被检测到,在许多情况下,它们的生物学意义在很大程度上是未知的。很明显,即使是同一癌症类型,不同患者之间在TME中每个Tc亚群的相对频率也存在很大差异。这种Tc亚群的组成可能会影响预后和生存,也可能影响针对免疫系统的新疗法的反应率。 进一步的研究将需要了解这些亚群在抗肿瘤反应中的确切功能,以及TME中影响它们分化的因素(见未解决的问题)。然后,可以开发新的治疗策略,以选择性靶向特定的Tc亚群,以增强癌症治疗和预后。