深圳市默赛尔生物医学科技发展有限公司
6 年
手机商铺
- NaN
- 0.7000000000000002
- 0.7000000000000002
- 1.7000000000000002
- 0.7000000000000002
推荐产品
公司新闻/正文
使用非基因修改技术生产类似CAR的NK细胞
953 人阅读发布时间:2025-03-14 10:06
自然杀伤(NK)细胞在肿瘤治疗上被认为相较于T细胞更加安全可靠。针对CD19靶点的嵌合抗原受体(CAR)-NK细胞也被证明在淋巴B细胞肿瘤患者的治疗中是安全而有效的。但CAR-NK细胞的制作过程非常复杂,且价格高昂。因此,在本研究中,一种被称为“别针”(Pin)技术的非基因修改技术被应用在了生产抗肿瘤NK细胞上。该方法使用脐血来源单个核细胞(PBMCs)与细胞因子IL-2/IL-15和转染了爱波斯坦-巴尔病毒(EBV)的B淋巴母细胞滋养层细胞来生产NK细胞,再使用改良过的抗CD20和抗CD19抗体(改良后的抗体对CD16a的亲和力变高)孵育扩增后NK细胞。最后生产出的NK细胞在膜表面的CD16a上附带有抗CD19/CD20的抗体,利用抗体依赖性细胞毒性来增强这些NK细胞对CD19或CD20阳性肿瘤细胞的杀伤。达到一种类似CAR-NK细胞的治疗效果。
别针单抗的生产和纯化
在人类IgG1的Fc的CH2结构域上端更改四个氨基酸:S239D/H268F/S324T/I332E。所有别针抗体都交由RD-Biotech (Besançon, France)生产。使用CHO细胞合成,蛋白A纯化。所有别针单抗的序列均来自于临床使用的单抗:别针-CD20单抗的抗原结合域序列来源于利妥昔单抗,别针-HER2单抗的抗原结合域序列来源于曲妥珠单抗,别针-EGFR单抗的抗原结合域序列来源于西妥昔单抗,别针-CD19单抗的抗原结合域序列来源于布纳吐莫单抗。
细胞
K562、Daudi、Toledo、Raji、MOLM-13、Namalwa、Ramos、Karpas、TDM8、SUDHL-10、SUDHL-6和SUDHL-4均购买自ATCC或ECACC。所有悬浮细胞培养在含10%FBS的RPMI-1640 GlutaMAX培养基中。HCT116、MDA-MB-468、MCF7培养在含10%FBS的DMEM高糖培养基中。淋巴瘤细胞患者来自蒙彼利埃CHU的CRB-CHUM平台。
抗体定量
细胞系和患者样本的CD19与CD20在细胞上的绝对值使用BD藻红蛋白PE荧光定量试剂盒(BD Biosciences),配合BD FACSCanto II 流式细胞仪(BD Biosciences)进行定量检测。
NK细胞体外扩增(eNK细胞生产)
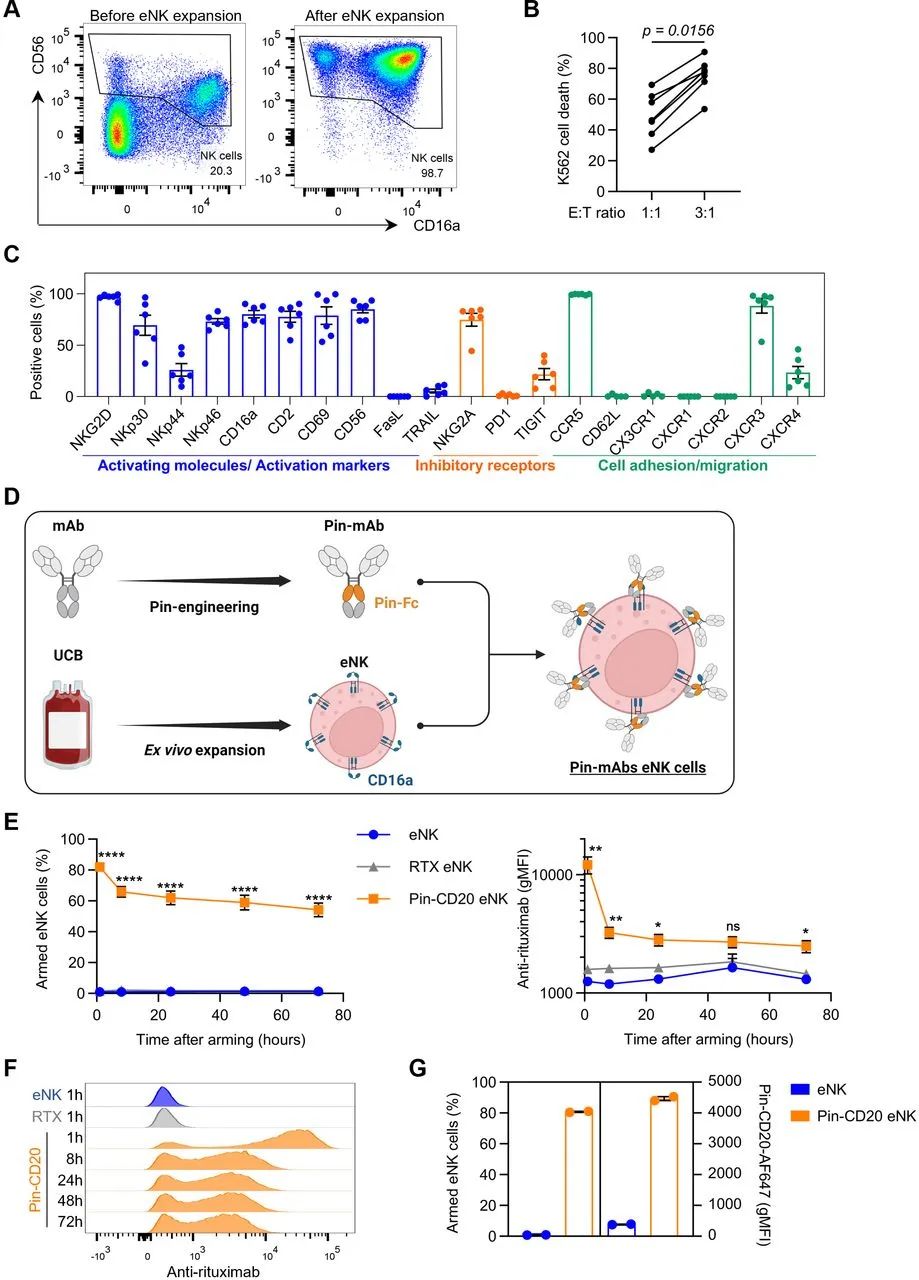
使用EasySep人类CD3阳性分选试剂盒II (STEMCELL)从脐血单个核细胞(UCBMCs)中去除CD3阳性的细胞,剩余的UCBMCs培养在含10%FBS(RPMI-1640)或5%人类血清(NK MACS)的培养基中,并额外添加100 IU/mL的IL-2和5 ng/mL的IL-15。在培养至Day5至Day7后,每2-3天全量更换新鲜培养基,并保证NK细胞密度至少有0.6×106个细胞/mL,培养至14至20天时,培养结束。在Day5至Day7后,70Gy单位辐照后的EBV转染B淋巴母细胞作为滋养层细胞会按照合适的比例加入到培养体系中。
体外扩增结束时,2×105个扩增后NK(eNK)会被收集并进行流式细胞术检测,检测以下标志物的表达:CD56、CD45、CD57、CD16、NKp30、NKp44、NKp46、NKG2A、NKG2C、NKG2D、CD2、CD69、CD62L、FasL、TIGIT、TRAIL、PD-1、CXCR1、CXCR2、CXCR3、CXCR4、CCR5、CX3CR1。
eNK细胞武装
使用Muse细胞分析仪(CYTEK)对eNK细胞进行计数,然后2×106个细胞/mL的eNK会被重悬在含10μg/mL的别针-CD20/CD19/EGFR/HER2单抗的RPMI-1640 GlutaMAX培养基中,在37℃下孵育1h。在部分实验中,一些别针单抗会被提前用荧光染料进行标记,以进行后续实验。
细胞毒性检测
eNK或别针单抗eNK会和CFSE标记或CellTrace Far Red标记的靶细胞按照特定的E:T比混合后接种到96孔板中,共培养24h。通过流式细胞术检测靶细胞被杀伤的程度。培养结束后,培养基上清会被收集检测分泌性因子的含量。
作为对比,健康贡献者PBMCs来源的eNK或别针CD20eNK会在E:T=1:1的情况下,孵育16h,再进行测试。
体内细胞毒性实验
NSG小鼠购买自IGMM。10周龄的雌性NSG小鼠会分别腹腔注射别针注射eNK、别针CD20-eNK、别针CD19-eNK,同时注射荧光标记的Nalm6细胞和Raji细胞或Daudi细胞。注射4h后,处死小鼠采集腹水细胞,去除红细胞后,对腹水细胞进行CD56、CD45进行染色标记(人源和鼠源同时染色),流式细胞术分析eNK细胞的存活能力和体内细胞毒性能力。
小鼠体内白血病模型
0.2×105个Raji细胞通过静脉注射到CB17 SCID小鼠的体内。在肿瘤细胞注射后第4天和第8天,粪便注射一次30×106个eNK或别针-CD20 eNK细胞,对照组小鼠注射纯PBS。在第11、14、17天时,静脉注射IL-15。第27天时,处死小鼠,收集肺、骨髓、血液。采集到的肺使用2mg/mL的分散酶II 37℃消化20min,用HBSS洗涤,通过40μm滤器过滤,收集单细胞。骨髓通过RBC裂解液裂解5min,用PBS洗涤,收集单细胞。所有样本经过CD20-PE标记和CD20-HLA-A/B/C-PerCP-Cy5.5标记后,进行流式细胞术检测,判断Raji细胞在各组织中的占比。
在体内和体外,eNK和别针-CD20抗体都可以稳定进行组装
通过对脐血来源单个核细胞进行IL2/IL-15刺激与滋养层细胞的加入,所生成的培养方案,成功获得了具有细胞完整细胞毒性和高纯度(CD56+CD3-细胞>95%)的eNK(见下图A,B)。eNK的抑制性受体与激活型受体表达均正常(见下图C)。通过对单抗进行改造,形成别针单抗,增强其对CD16a的亲和力,用来武装eNK,并最终产生了别针单抗eNK(见下图D)。按照别针抗体和eNK的孵育方案,80%的eNK都被证明结合了别针抗体,而不同的利妥昔单抗不能持续性和eNK结合(见下图E,F)。SCID小鼠腹腔别针-CD20 eNK注射结果表明,在注射后24h,仍有80%的eNK仍然携带别针抗体(见下图G)。
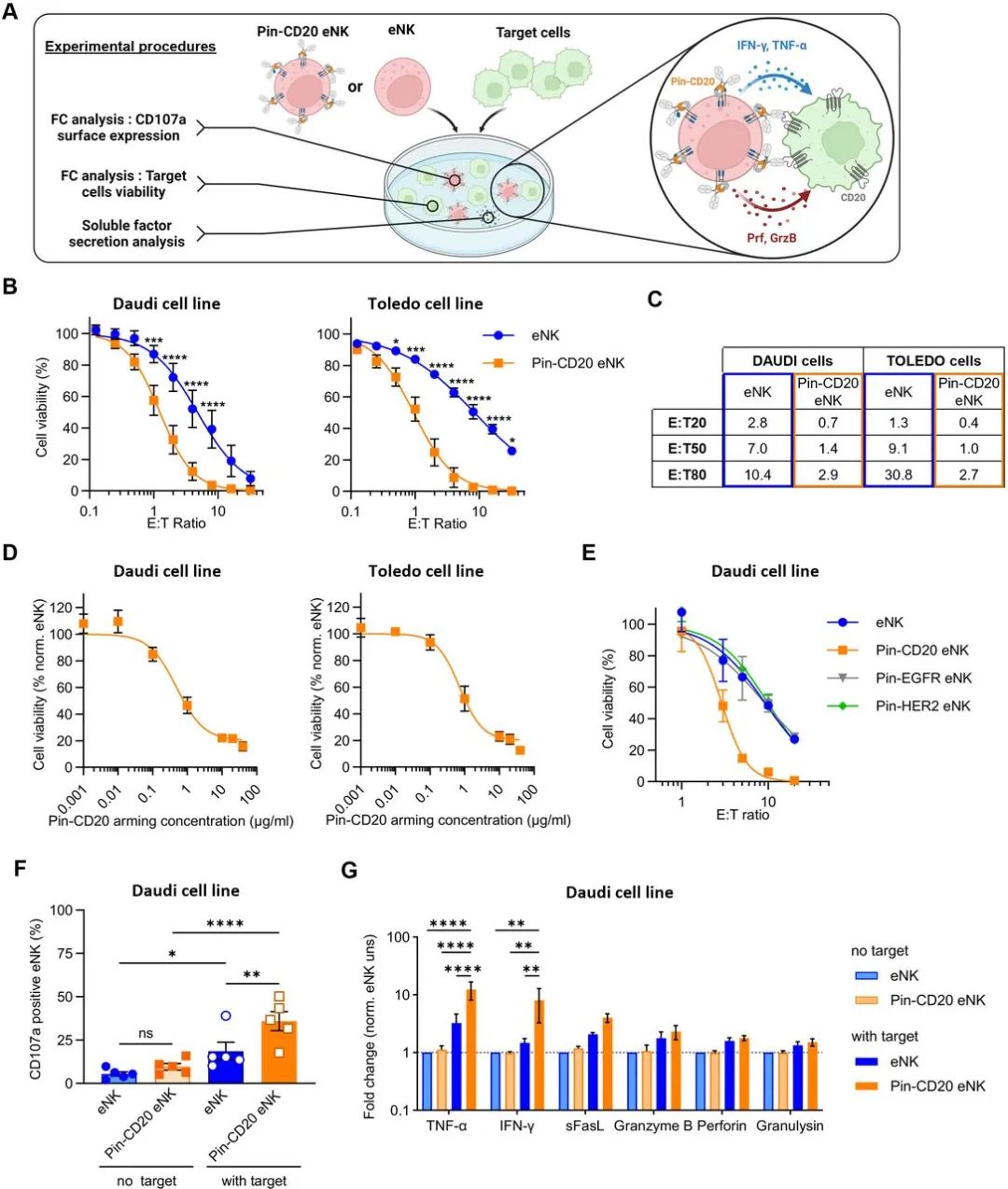
在体外针对B淋巴细胞系时,别针-CD20 eNK产生了别针单抗依赖性细胞毒性(Pin-ADCC)
在体外杀伤实验中,普通的eNK和别针-CD20 eNK分别与靶细胞进行孵育(见下图A)。Daudi和Toledo分别为高CD20表达和低CD20表达细胞株,在几乎所有E:T比下,相对于eNK,别针-CD20 eNK对两种靶细胞都表现出了更强的细胞毒性(见下图B,C)。对于使用别针-CD20单抗武装eNK细胞的浓度进行改变,发现使用大约40μg/mL的别针单抗孵育eNK,能达到更好的杀伤效果(见下图D)。而使用别针-HER2、别针-EGFR单抗孵育eNK,并没有增强eNK杀伤Daudi细胞的效果,但是也不影响其本身的细胞毒性(见下图E)。别针-CD20单抗和eNK的结合并未使得CD107a表达,分泌性杀伤分子的分泌也没有增加,不过当靶细胞被加入培养中市,别针-CD20 eNK表现出了更强的CD107a表达和更强的抗肿瘤因子分泌能力(见下图F,G)。
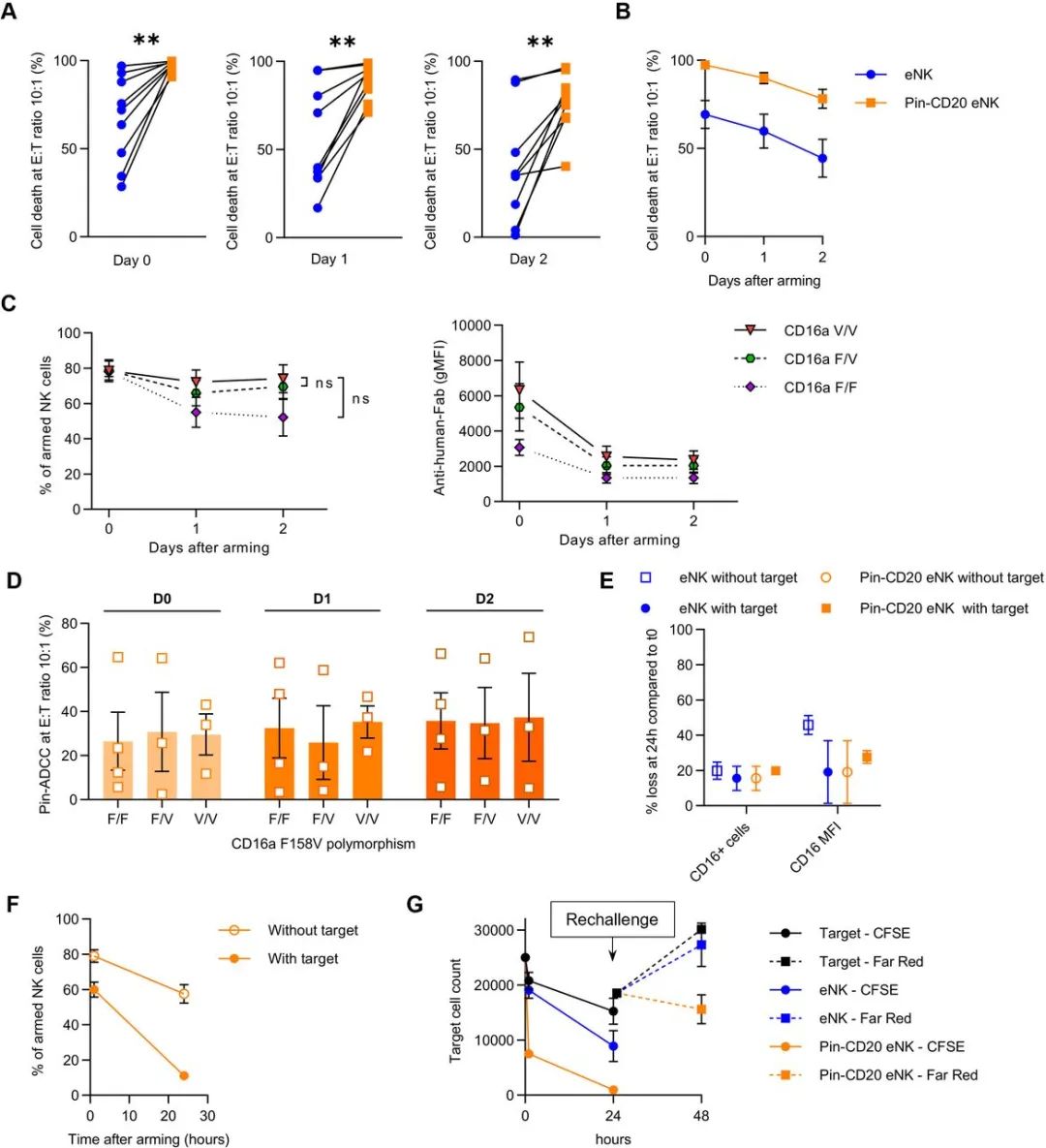
别针-CD20 eNK表现出一种长期性增强型细胞毒性
在E:T比为10:1的情况下,别针-CD20 eNK相对于普通eNK表现出更多细胞占比(Day0:97%vs69%;Day1:89%vs59%;Day2:78%vs44%)(见下图A)。在没有因子刺激下,继续培养时,别针-CD20 eNK的持续性更强,尽管出现了和普通eNK一样的下降趋势(见下图C)。CD16a的F158V多态性对别针抗体结合CD16a存在一定影响,CD16a存在CD16aV158(V/V)或F158(F/F)两种纯合或杂合(F/V)状态,尽管没有观察到统计学差异,但V/V相比F/F的CD16a更能与别针抗体形成稳定结合(见下图C)。V/V、F/F、V/F三种类型的eNK在别针抗体依赖性细胞毒性上并未观察到显著性差异(见下图D)。
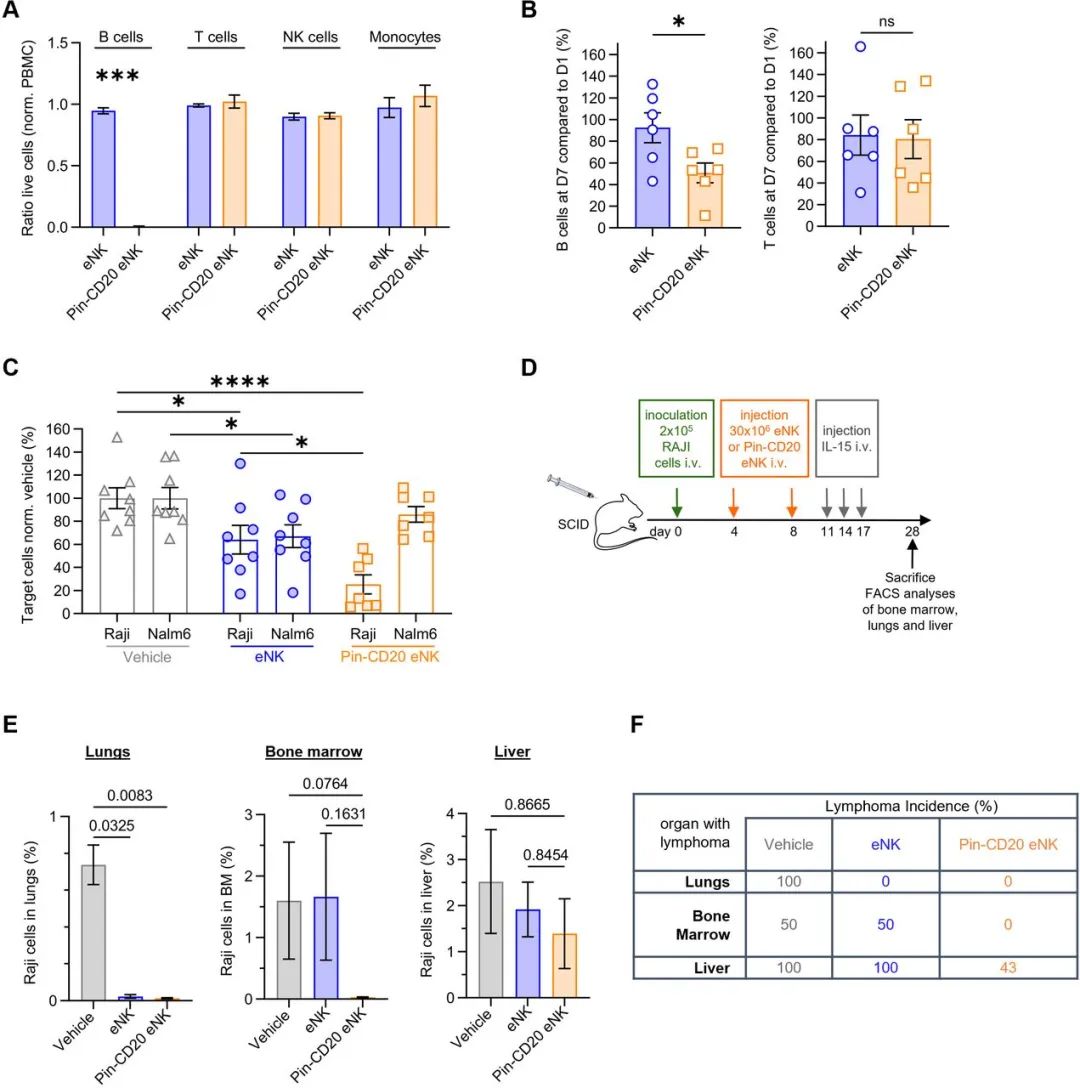
别针-CD20 eNK在体内能高效清除CD20阳性的靶细胞
在人源化NCG小鼠CD20阳性B细胞模型中,初步实验表明,正常健康贡献者PBMCs来源的别针-CD20 eNK会选择性清除B细胞,但不会对其他免疫细胞产生杀伤,普通的eNK并未表现出细胞毒性(见下图A)。在人源化小鼠中,静脉注射eNK或别针-CD20 eNK细胞7天后,相比eNK,别针CD20 eNK消耗掉了近50%的B细胞,但二者对T细胞没有影响(见下图B)。分别注射Raji(CD20高表达)、Nalm6(CD20不表达)到小鼠体内后,再注射eNK或别针CD20 eNK后,结果表明别针-CD20 eNK会选择性地靶向CD20阳性细胞并杀死它们(见下图C)。在抗肿瘤模型中,SCID小鼠在静脉注射Raji细胞后,分别在第4天和第8天注射两剂eNK或别针-CD20 eNK(见下图D)。相对于对照组,eNK和别针-CD20 eNK都成功清除了骨髓中的Raji细胞,但只有别针-CD20 eNK成功清除了肝脏中的肿瘤细胞,并且减少了肿瘤细胞在其他器官中积累(见下图E,F)。
别针抗体增强了eNK细胞面对原发性B淋巴细胞瘤患者时的细胞毒性
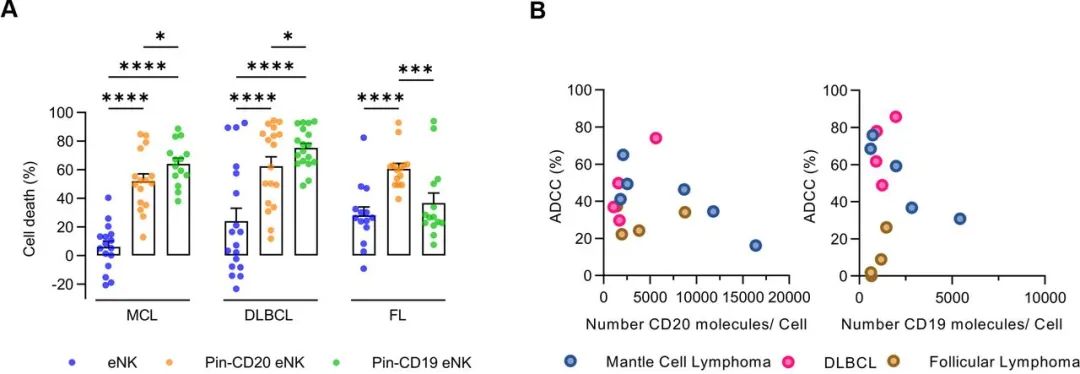
CD19作为另一种表达更为广谱的靶标已经被应用在了CAR-T和CAR-NK上,可以在患者肿瘤细胞CD20下调或对利妥昔单抗产生耐药性时,作为另一种B淋巴细胞瘤患者的潜在靶点。利用别针CD20-eNK和别针CD19-eNK,同时对套细胞淋巴瘤(MCL)、弥散性大B细胞淋巴瘤(DLBCL)、滤泡性淋巴瘤(FL)的原发性患者的肿瘤细胞进行了测试。相对于eNK(MCL:6%; DLBCL:23%;FL:28%),别针CD20-eNK对所有原发性肿瘤细胞都存在一定毒性(MCL:52%; DLBCL:62%;FL:60%),而别针CD19-eNK对除了FL以外的原发性肿瘤细胞都能有效清除(MCL:64%; DLBCL:75%;FL:37%)(见下图A)。CD19可能相较于CD20,更是作为别针单抗eNK细胞的靶点,且观察到白细胞膜表面的抗原密度和别针单抗eNK的细胞毒性无关(见下图B)。
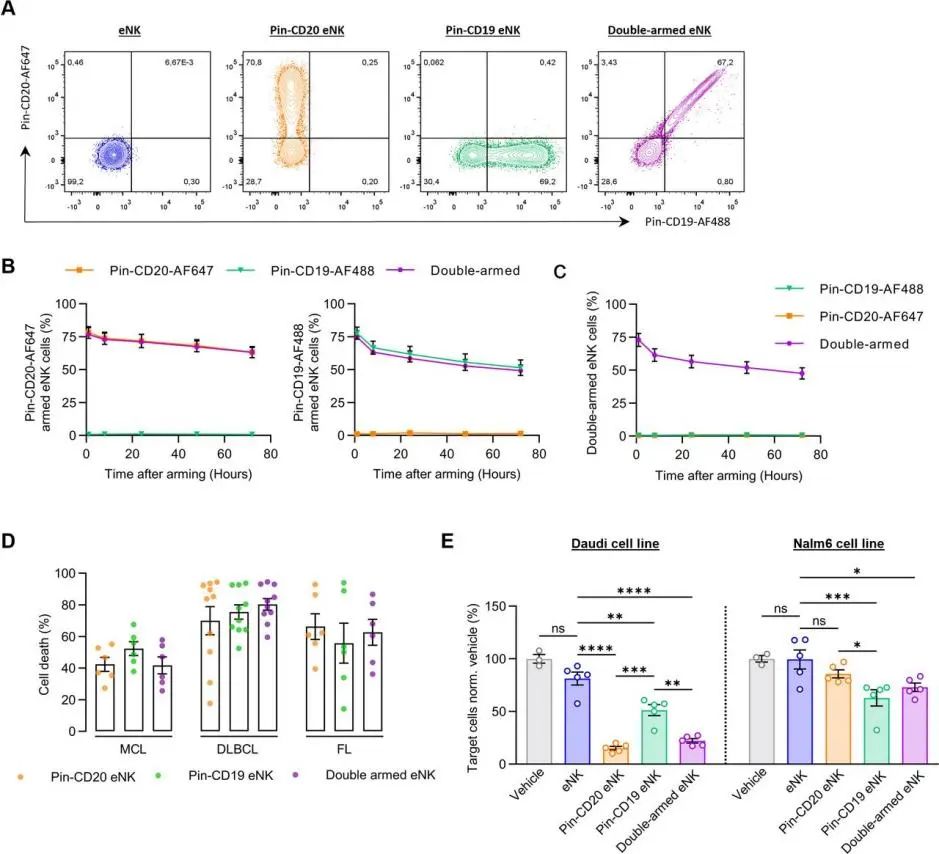
双重别针武装的eNK增加了别针抗体的使用潜力
使用两种别针单抗武装eNK,生产双抗体eNK。成功构建出了别针CD20/别针CD19-eNK(见下图A)。别针CD19单抗和别针CD20单抗表现出了类似的结合动力学(见下图B)。在两种抗体孵育eNK的72h后,仍有50%的eNK表现出双抗体结合(见下图C)。在原发性B细胞淋巴瘤患者中,双单抗eNK表现出了与别针CD20-eNK和别针CD19-eNK相同的效力(见下图D)。分别使用eNK、别针CD20-eNK、别针CD19-eNK、双别针eNK,对注射有Daudi细胞(CD19、CD20双阳)、Nalm6(CD19+CD20-)的小鼠进行治疗,双单抗eNK很好的杀死了两种肿瘤细胞,但别针CD20-eNK对Nalm6细胞的清除乏力(见下图E)。
对临床应用单抗的Fc上CH2结构域进行氨基酸替换,以增强其结合自然杀伤(NK)细胞CD16a亲和力,并以此制作出结合有针对CD19、CD20靶标的单抗的NK细胞。赋予了NK细胞类似于CAR-T或CAR-NK细胞一样的靶向效果,并通过抗体依赖性细胞毒性增强了其对抗肿瘤细胞的能力,以达到类似CAR细胞的治疗效果。关键在于,该方法并不会对NK细胞本身进行基因修饰。同时,通过修改抗体可以对任何潜在靶点实施靶向治疗效果。因此该方法具有很强的潜力。
DOI:10.1136/jitc-2024-009070